023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


基于荧光的定量实时PCR (qPCR)的出现使许多领域的基因表达定量分析发生了革命性的变化,包括生命科学、农业、法医学、分子诊断学和医学。虽然基于SYBR Green的qPCR由于其廉价的性质和稳定的化学性质而成为最常用的平台,但对低丰度基因或从高度受限或有限来源提取的RNA样品的表达进行定量可能具有挑战性,因为基于SYBR Green的qPCR的检测灵敏度有限。在这里,我们通过在定量扩增阶段之前加入4个循环的触地阶段,开发了一种新的有效的触地qPCR (TqPCR)方案。使用相同的cDNA模板,我们发现与常规qPCR相比,TqPCR可以将Gapdh、Rps13和Hprt1参照基因的平均Cq值分别减少4.45、5.47和4.94个循环;三个参照基因的总体平均Cq值降低了4.95。我们进一步发现TqPCR可以提高PCR扩增效率,从而提高检测灵敏度。当分析间充质干细胞中Wnt3A诱导的靶基因表达的定量时,我们发现,尽管常规qPCR和TqPCR都可以检测相对丰富的靶Axin2的上调,但只有TqPCR可以检测低表达的靶Oct4和Gbx2的上调。最后,我们证明了来自小鼠参考基因Tbp的MRQ2和MRQ3引物对可用于验证qPCR样品的RNA/cDNA完整性。总之,我们的结果强烈表明TqPCR可以提高检测灵敏度和PCR扩增效率。总的来说,TqPCR在表达定量方面应优于常规qPCR,尤其是当感兴趣的转录物低表达和/或总RNA的可用性高度受限或有限时。
基因表达反映了个体的遗传素质和生理状况[1–4]。通过测量基因表达,有可能评估一个人的健康状况,并监测一个人对药物、治疗和改变的生活条件的反应。基于荧光的定量实时PCR (qPCR)的出现彻底改变了基因表达的定量领域[2–4]。该技术能够检测和测量各种样品中的微量核酸,在均相检测中兼具简单、快速、灵敏和特异性,已广泛用于生命科学、农业和医学,以及分子诊断,包括微生物定量、基因剂量测定、转基因食品中转基因的鉴定、癌症复发的风险评估和法医应用[2,3]。
qPCR的实时性质允许在发生时收集定量数据,因此将扩增和检测结合到单一步骤中。这个过程是通过使用不同的荧光化学物质来实现的,这些化学物质将PCR产物浓度与荧光强度相关联。PCR反应的特征在于首次检测到靶扩增的时间点(或PCR循环数),因为荧光强度大于背景;这通常被称为周期阈值(Cq)。因此,起始材料中靶DNA的量越大,荧光信号的显着增加出现得越早,产生的Cq值越低。qPCR比其他定量基因表达的方法有许多优点。它具有7到8个对数数量级的精确动态范围,并且不需要放大后操作[5]。事实上,qPCR比RNase保护试验灵敏10,000-100,000倍[6],比斑点杂交灵敏1000倍[7],甚至可以检测特定转录物的单个拷贝[8]。此外,qPCR分析可以检测样品之间小至23%的基因表达差异[5,9]。
尽管qPCR已成为许多实验室的标准分析,但定量结果会受到许多因素的严重影响,包括RNA模板的可变性、分析设计和方案,以及不适当的数据标准化和不一致的数据分析。因此,MIQE指南已经发布,以说明生成可靠且可重现的定量数据所需的基本技术步骤[10]。SYBR Green-based qPCR是最常用的平台之一,因为它价格低廉,化学性质稳定[2,11]。然而,由于基于SYBR Green的qPCR分析的检测灵敏度有限,对低丰度基因或从高度受限或有限来源提取的RNA样品的表达定量可能具有挑战性。
在这项研究中,我们开发了一种新的有效的触地qPCR (TqPCR)方案,在定量扩增阶段之前加入了一个4循环触地阶段。使用相同的cDNA模板,我们发现,与常规qPCR相比,TqPCR可以将Gapdh、Rps13和Hprt1参照基因的平均Cq值分别降低4.45、5.47和4.94个循环,而所有三个参照基因的总Cq值降低了4.95。我们还发现TqPCR可以提高PCR效率,从而提高检测灵敏度。当对间充质干细胞中Wnt3A诱导的靶基因表达进行定量时,我们发现,尽管常规qPCR和TqPCR都能够检测相对丰富的靶Axin2的诱导表达,但只有TqPCR能够检测低表达靶Oct4和Gbx2的上调。此外,我们证明了来自小鼠参考基因Tbp的MRQ2和MRQ3引物对可用于验证qPCR样品的RNA/cDNA完整性。总之,我们的结果表明TqPCR可以提高检测灵敏度和PCR扩增效率。因此,当感兴趣的转录物低表达,和/或总RNA的可用性高度受限或有限时,TqPCR在表达定量方面应优于常规qPCR。
方法:
常规定量实时PCR (qPCR):
所有qPCR反应都是根据MIQE指南设计和实施的[10]。本研究中使用的PCR引物是通过使用基于网络的Primer3Plus程序[26]设计的,并在S1和S2表格中列出。PCR扩增子的大小范围从80-bp到250-bp。qPCR分析通过使用Opticon II DNA Engine (Bio-Rad,CA)和CFX-Connect (Bio-Rad)进行,如[16,18,23,25,27–34]所述。qPCR反应一式三份进行。简而言之,使用带有EvaGreen或iTaq Universal SYBR Green super mix(Bio-Rad)的2x SsoFast qPCR Supermix,qPCR反应如下进行:95℃×3’一个循环;95°C×20s、55°C×10s、70°C×1s,然后读取板读数,共40个循环。进行cDNA样品的系列稀释以确定每个引物对的扩增效率。没有模板对照(NTC)被用作阴性对照。
接地qPCR (TqPCR):
使用相同的热循环仪装置、Opticon II DNA Engine和CFX-Connect以及带有EvaGreen或iTaq Universal SYBR Green Supermix的2x SsoFast qPCR Supermix进行TqPCR。使用以下条件进行三次TqPCR反应:95℃×3min一个循环;95°C×20s,66°C×10s,4个循环,每个循环降低3°C;95°C×20s、55°C×10s、70°C×1s,然后读取板读数,共40个循环。进行cDNA样品的系列稀释以确定每个引物对的扩增效率。没有模板对照(NTC)被用作阴性对照。
结果:
增加触地阶段扩展了qPCR的动态范围
尽管基于SYBR-Green的qPCR是确定细胞和/或组织中基因表达水平最常用的技术之一,但由于SYBR Green检测的有限灵敏度,低转录本丰度基因的表达可能具有挑战性。我们试图测试在定量扩增循环之前包括几个触地步骤是否会增加检测灵敏度。我们使用系列稀释的pUC19质粒DNA样品在较旧的热循环仪DNA Engine OPTICON II上进行了比较研究。66℃、63℃、60℃和57℃下的四个接地步骤被手动添加到PCR循环程序中。我们发现常规qPCR程序的荧光值产生了比TqPCR明显更窄的检测范围,qPCR和TqPCR分别为5.0~0.008pg和5.0 ~ 0.0005 pg(图1A,图a对b)。此外,这些数据还表明TqPCR将检测灵敏度提高了16倍。
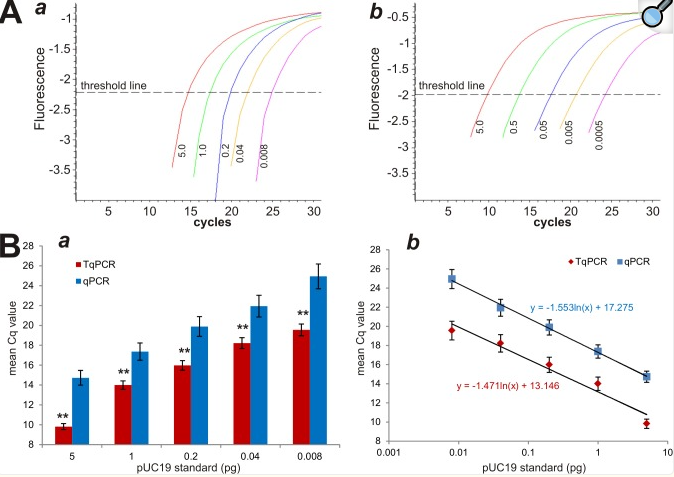
图1 在定量扩增pUC19中的靶序列时常规qPCR和触地qPCR (TqPCR)之间的比较。(A)TqPCR扩大了DNA水平的检测极限。对pUC19质粒特异的PCR引物用于扩增系列稀释的pUC19 DNA,热循环程序使用DNAEngine OPTICON II单位(Bio-Rad)进行。为常规qPCR (a)和TqPCR(b)绘制PCR扩增曲线(例如,SYBR绿色荧光历史对循环数)。(B)常规qPCR和TqPCR反应之间的Cq值比较。使用pUC19 DNA的相同稀释系列获得qPCR和TqPCR的平均Cq值(a)。用散点图(b)建立标准曲线。每个检测条件进行三次重复。“**”,表明qPCR和TqPCR组之间的Cq差异显著,p<0.001。
我们进一步分析了在同一组模板上进行的PCR反应的Cq值,发现在每个模板浓度下,在TqPCR组中始终观察到明显低于常规qPCR组的Cq值(p<0.001)(图1B,图a)。当在散点图上分析标准曲线时,我们发现两个方案的校准曲线几乎平行,具有相似的斜率(图1B,分图b),表明增加四个触地步骤似乎使标准曲线下移。这些结果强烈表明TqPCR可以提高检测灵敏度。
TqPCR方案显著提高了PCR扩增效率和检测灵敏度,尤其是对于低丰度转录物
扩增效率对于准确解释qPCR数据至关重要。理想的效率应该是100%,这意味着在反应的对数期,感兴趣的PCR产物随着每个循环增加一倍。例如,完美的PCR效率将在模板的10倍系列稀释之间显示3.3个循环的变化。然而,扩增效率会受到模板、引物和荧光化学性质的显著影响,导致效率低于或高于100%。使用相对较新且常用的qPCR单元CFX-Connect,我们对常规qPCR和TqPCR方案检测具有显著不同丰度的基因表达的能力进行了全面的比较研究。我们选择了三个参考基因,Gapdh、Rps13和Hprt1,分别具有高丰度、中等丰度和低丰度[47-50]。作为最常用的参考基因之一,Gapdh应该在大多数细胞中高度表达。当cDNA样品以5倍系列稀释制备时,Gapdh表达很容易通过常规qPCR和TqPCR检测到(图2A和2B)。然而,显示相对荧光信号在TqPCR中比在常规组中出现得更早(图2A-a对2B-a)。当对PCR效率进行分析和作图时,我们发现两种方案都产生了可比较的高相关系数(图2A-b和2B-b)。然而,与常规qPCR (80.9%)相比,TqPCR方案显著提高了PCR扩增效率(99.6%)(图2A-b对2B-b)。绘制平均Cq值清楚地表明,TqPCR方案始终比常规qPCR方案产生显著更低的Cq值(p<0.001)(图2C)。qPCR和TqPCR之间的平均Cq值差为4.45。此外,值得注意的是,在与TqPCR相同的条件下,常规qPCR未能产生两个最高稀释度的可靠扩增(图2A和2C)。这些结果表明,TqPCR方案可以提高扩增效率,从而提高检测灵敏度,甚至对于丰富的基因如Gapdh也有效。
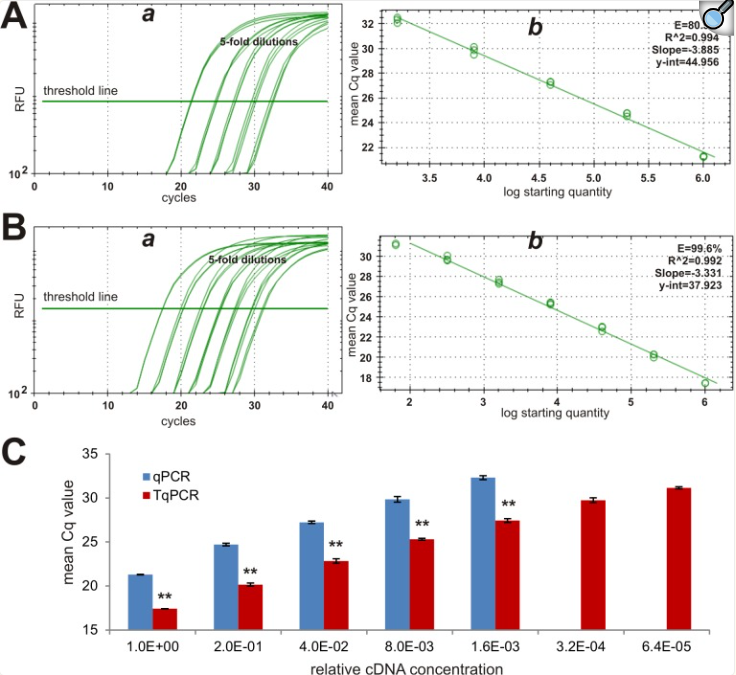
图2 常规qPCR和TqPCR检测高丰度参考基因Gapdh表达的比较分析。从指数生长的iMEF细胞制备cDNA样品,并连续稀释5倍用于PCR扩增。使用CFX-Connect qPCR单元(Bio-Rad ),通过常规qPCR (A)和TqPCR (B)方案,使用小鼠Gapdh特异性引物检测Gapdh表达。分析并给出了qPCR SYBR绿色荧光历史与循环数的关系(a)和Gapdh的qPCR效率(b)。两种方法的平均Cq值比较进一步用图表表示(C)。注意,qPCR方案对于两个最稀释的cDNA样品没有产生可靠的结果。“**”,表明qPCR和TqPCR组之间的Cq差异显著,p<0.001。
我们接下来分析了中等丰度参考基因Rps13的表达。类似于用Gapdh表达观察到的情况,TqPCR方案将相对荧光信号向左移动,比qPCR组出现得更早(图3A对3B)。此外,似乎TqPCR方案也可以增加扩增效率(85.7%对81.6%)(图3A-b对3B-b)。TqPCR的平均Cq值始终低于qPCR (p<0.001)(图3C)。事实上,qPCR和TqPCR之间的平均Cq值差是5.47。这些结果进一步证实了TqPCR可以提高PCR效率和增加检测灵敏度。
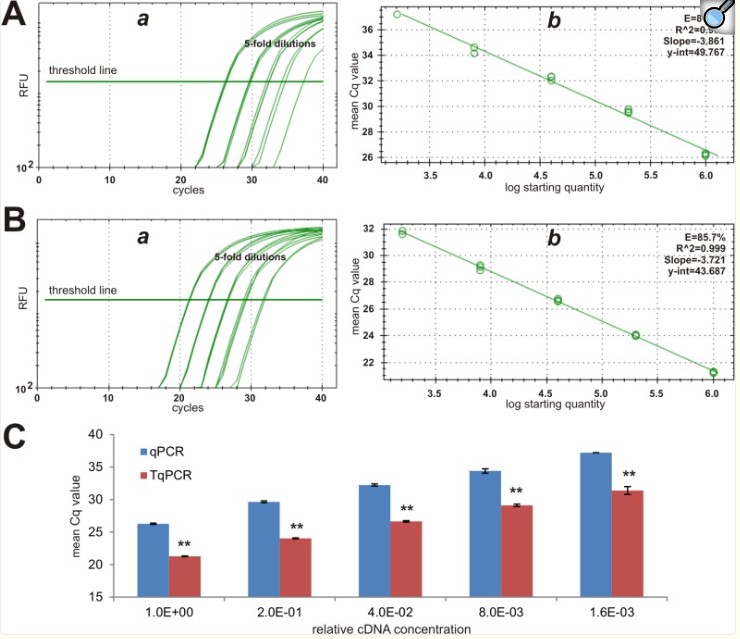
图3 常规qPCR和TqPCR检测适度丰富参考基因Rps13表达的比较分析。
因为Hprt1通常被认为具有低丰度,所以它应该是测试qPCR检测灵敏度的理想参考基因。与其低表达水平一致,qPCR组中具有最低稀释度的模板的平均Cq值为30.62个循环,而TqPCR组中相同模板的Cq值为25.40(图4A-a对4B-a)。此外,TqPCR方案将PCR扩增效率从常规qPCR中的114.8%提高到109.1%(图4A-b对4B-b)。根据MIQE指南,理想的PCR效率是100%,而可接受的范围是从80%到120% [10]。TqPCR组的平均Cq值显著低于常规qPCR组(p<0.001)(图4C)。qPCR和TqPCR之间的平均Cq值差为4.94。重要的是要注意,与TqPCR不同,常规qPCR无法对两个最高稀释度的模板产生可靠的Cq值(图4A & 4C),这表明TqPCR具有优异的检测灵敏度。综上所述,上述结果强烈表明,优化的TqPCR方案可以通过提高扩增效率来扩大动态范围和检测灵敏度。
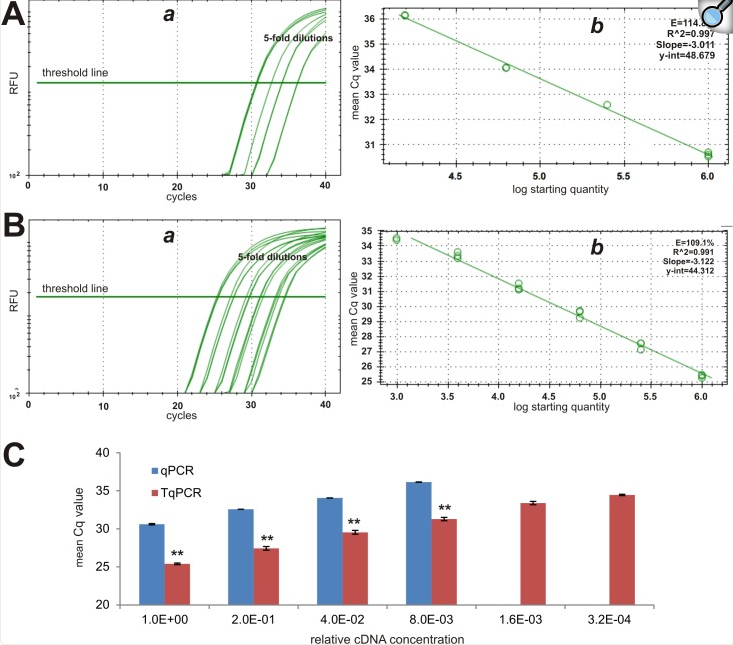
图4 常规qPCR和TqPCR检测低丰度参考基因Hprt1表达的对比分析。
通过TqPCR更有效地检测间充质干细胞(MSCs)中Wnt3A诱导的下游靶基因的表达
我们接下来试图使用TqPCR与常规qPCR方案来确定Wnt3A诱导的MSC细胞中的靶基因表达。连同许多其他信号通路,如BMP和IGFs [51,52],Wnt信号通路在调节MSCs的增殖和分化中起着重要作用[53,54]。我们使用重组腺病毒转导永生化小鼠胚胎成纤维细胞(iMEFs)并表达Wnt3A,这应该激活规范的β-连环蛋白/Tcf4途径并调节一组充分表征的下游靶基因,如axin 2[55–57],Oct4 [58],Gbx2 [59]和NeuroD1 [60]。我们用AdWnt3A或AdGFP转导iMEFs小时,并分离总RNA用于逆转录。cDNA样品用于qPCR和TqPCR分析,用于上述四种靶基因和Gapdh参照基因的表达。我们发现Wnt3A表达可在不同程度上上调这些靶基因(即,如较低的Cq值所示),而Gapdh表达独立于Wnt3A表达(图5A)。具体而言,虽然qPCR和TqPCR分析均显示Wnt3A上调Axin2表达(p<0.001),但只有TqPCR分析揭示Wnt3A上调Oct4和Gbx2表达(均p<0.001)(图5B)。在Neurod1表达的情况下,虽然qPCR和TqPCR都检测到Neurod1表达的Wnt3A依赖性上调,但TqPCR分析显示比常规qPCR分析(2.84倍,p<0.05)更显著的上调(4.88倍,p<0.001)(图5B)。这些结果进一步证明TqPCR方案在检测Wnt3A诱导的靶基因表达中更灵敏和有效,尤其是当靶基因丰度低时(例如,Cq > 30)。
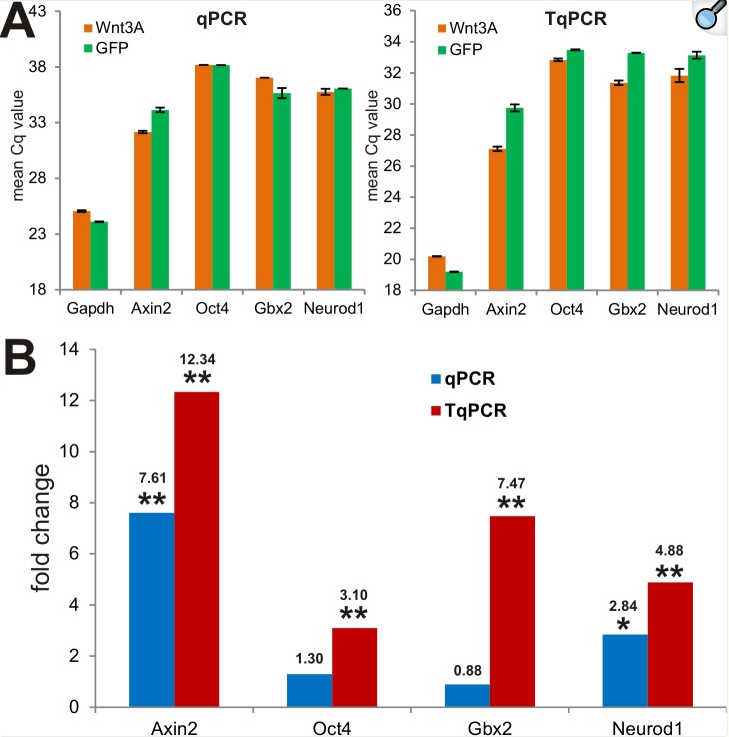
图5 通过TqPCR更有效地检测间充质干细胞中Wnt3A诱导的下游靶基因的表达。
讨论:
TqPCR有效地降低了Cq值并提高了检测限(LOD)
基于SYBR Green的基因表达qPCR分析是分子细胞生物学研究中最常用的分析方法之一。然而,在大多数扩增条件下,Cq>35通常产生不太可靠的结果。qPCR的分析灵敏度通常是指一个样本中可以准确测量的最小拷贝数。通常,灵敏度以检测限(LOD)表示,检测限是指在给定的分析程序中,能够以合理的确定性(通常为95%的概率)检测到的浓度[10]。虽然增加cDNA的浓度是降低Cq的一种方式,但是当感兴趣的转录物以极低的水平表达时,和/或用于RNA和cDNA制备的样品/细胞的可用性极其有限时,这可能是不切实际的。
在本报告中,我们证明了通过在qPCR分析的初始阶段引入四个触地步骤,我们能够比传统的qPCR方案显著降低Cq值。具体地,使用cDNA模板的样品组和/或在相同的稀释度下,我们发现,与常规qPCR方案相比,我们优化的TqPCR方案可以将Gapdh、Rps13和Hprt1表达的平均Cq值分别降低4.45、5.47和4.94个循环。测试的三个参考基因(Gapdh、Rps13和Hprt1)的平均总Cq值降低为4.95。因此,TqPCR可以有效地增加检测灵敏度,这对于从极其有限的数量分析低拷贝基因和/或cDNA样品的表达应该是非常有益的。
TqPCR似乎提高了PCR扩增效率
对于相对定量来说至关重要的是,PCR效率可以影响荧光历史和计算的表达结果的准确性[10,61]。在动力学qPCR中,单个样品可能会产生不同的荧光历史。所有比较样品中的高且恒定的扩增效率是样品间可靠比较的重要标准[5,61–65]。理想的扩增效率是100%,假设PCR产物浓度在反应的指数期内每个循环都翻倍,实际上,扩增效率从指数期早期的相对稳定变化,并逐渐下降到零,这是由PCR成分的耗尽、聚合酶活性的下降以及与其他PCR产物的竞争引起的[5]。因此,PCR扩增效率通常通过校准或使用标准曲线来确定,可接受的扩增效率范围为80%至120% [10]。
在本研究中,我们发现TqPCR方案提高了扩增效率。例如,在小鼠Gapdh表达分析中,常规qPCR的扩增效率为80.9%,但TqPCR增加到99.6%。对于Rps13表达分析,qPCR的效率为81.6%,而TqPCR的效率为85.7%。在Hprt1表达的情况下,常规qPCR的效率为114.8%,而TqPCR的效率为109.1%,接近可接受的标准100%。虽然我们没有对TqPCR提高效率的全面解释,但可以想象的是,最初的触地步骤可以促进靶特异性扩增并产生大量的特异性产物,这些产物很容易作为扩增指数期的模板。此外,上述可能性可以解释当与常规qPCR相比时,TqPCR协议如何有效地降低Cq值。我们的发现与之前的观察结果一致,其中触地或降压PCR可以提高PCR扩增的特异性和敏感性[66,67]。
RNA完整性和cDNA质量的评估可以通过一组自制的RQ引物来实现
多种方法,如A 260/A 280比率、凝胶电泳、基于微流体的rRNA分析和荧光RNA结合染料测量,已被用于确定RNA质量,因为高RNA完整性对于获得有意义和可重复的基因表达数据至关重要[2,68–72]。参考/靶基因3':5 '完整性分析是另一种在一个步骤中确定RNA质量和cDNA完整性的有用方法[2]。这种方法包括使用两对PCR引物来扩增基因的3’和5’末端。使用3':5 '检测要求两对引物的PCR效率几乎相同[2]。理想情况下,检测应针对一组3':5 '阈值比率约为0.2–5的完整性参照基因[10]。Bio-Rad提供预先验证的RQ1和RQ2引物(用于小鼠或人类样本)来确定RNA/cDNA的完整性。
为了开发一套普遍适用且成本低廉的RQ引物,我们鉴定了一组来自小鼠参考基因Tbp的PCR引物,并定位了Tbp mRNA的不同区域。我们选择参考基因Tbp作为目标,因为它的表达水平被认为是中低丰度的,其应该足够敏感以区分和验证不同样品之间的RNA/cDNA完整性。使用Bio-Rad的小鼠RQ引物(例如,BRQ1和BRQ2)作为阳性对照,我们分析了对应于小鼠Tbp转录物的六个引物(MRQ1-6 ),这些转录物在一组13个cDNA样品上具有显著不同的RNA/cDNA完整性,并且发现两个重叠的引物对,MRQ2和MRQ3,可以以与BRQ引物对(R = 0.96)相同的方式区分cDNA质量(两对之间的Cq差异)。MRQ引物对的另外两个组合,MRQ2/MRQ5和MRQ2/MRQ4,在验证13个测试的cDNA样品的质量方面,也表现出与BRQ1/BRQ2高度显著的相关性(分别R = 0.89和R = 0.87)。我们发现,如果两个MRQ引物对之间的Cq差异< 2,则RNA完整性和cDNA质量是可接受的。因此,这些MRQ引物对应该是有价值的资源,并且普遍适用于验证小鼠样品的RNA完整性和cDNA质量。
间充质干细胞中Wnt3A诱导的靶基因表达的定量验证了TqPCR方案的优势
在我们的原理验证研究中,我们证明了TqPCR方案在检测间充质干细胞中已知Wnt3A靶基因的上调方面更有效。Wnt是调节许多发育过程的分泌型糖蛋白家族[73]。Wnt信号在骨骼发育中起着重要作用[54,74]。Wnt蛋白与其同源受体frizzled (Fz)和LRP-5/6共受体结合,并激活不同的信号通路,包括经典的β-连环蛋白通路,其中β-连环蛋白在细胞质中积累并转运到细胞核中,在细胞核中与Tcf/LEF转录因子结合,以调节靶基因的表达,如axin 2[55-57],Oct4 [58],Gbx2 [59]和NeuroD1 [60]及其他[53,75-77]。
我们比较了用常规qPCR和TqPCR定量的Wnt3A诱导的靶基因表达。在这些检测的靶基因中,Axin2的丰度最高,因此常规qPCR和TqPCR都可以容易地检测Wnt3A刺激后的上调。然而,对于丰度相对较低的两个靶基因Oct4和Gbx2,常规qPCR未能检测到Wnt3A对其表达的任何显着诱导,而在相同的模板条件下,TqPCR显示Oct4和Gbx2的表达分别被Wnt3A诱导了3.1和7.5倍。因此,这些结果进一步证实TqPCR可以显著增加基因表达定量的检测灵敏度。当感兴趣的转录物低表达时,和/或总RNA的可用性高度受限或有限时,例如来自单细胞、血浆、无细胞体液、激光捕获的切片或澄清的组织,TqPCR应该比常规qPCR特别有利。
总之,我们开发了一种新的有效的qPCR方案,TqPCR,通过在定量扩增阶段之前加入一个触地阶段。使用相同稀释度的相同cDNA模板,我们发现与常规qPCR相比,TqPCR可以分别平均降低Gapdh、Rps13和Hprt1参考基因表达的Cq值4.45、5.47和4.94个循环。测试的三个参考基因的平均总Cq值降低为4.95。我们还发现TqPCR可以提高PCR效率,从而提高检测灵敏度。当对间充质干细胞中Wnt3A诱导的靶基因表达进行定量时,我们发现TqPCR,而不是常规qPCR,显示出有效地检测低表达的Oct4和Gbx2的上调,而常规qPCR和TqPCR都能够检测相对丰富的靶Axin2的诱导表达。此外,我们评估并鉴定了至少两对来源于小鼠参考基因Tbp转录物的RNA完整性/质量引物(MRQs ),可以可靠地验证RNA/cDNA的完整性。总之,我们的发现表明TqPCR可以提高检测灵敏度和PCR扩增效率。因此,当感兴趣的转录物低表达,和/或总RNA的可用性高度受限或有限时,TqPCR在表达定量方面应优于常规qPCR。