023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


基因表达毒性是一种重要的生物现象,也是生物技术的一大瓶颈。大肠杆菌BL21(DE3)是重组蛋白生产的最受欢迎的宿主,并且已经开发或改造了各种衍生物以促进提高产量和对毒性基因的耐受性。然而,以前进化BL21的努力,如Walker菌株C41和C43,仅导致T7系统表达强度的降低。这几乎没有揭示起作用的机制,并且仅构成向通常更高产量的细胞工厂的微小进步。在这里,我们限制了BL21(DE3)进化耐受性的解决方案空间,并分离出必需RNase E截短的突变株Evo21(DE3)。这表明RNA稳定性在基因表达毒性中起着重要作用。进化的rne截短类似于先前工程改造到商业上可获得的BL21Star(DE3)中的突变,这挑战了现有的假设,即该菌株不适合表达毒性蛋白。我们在RNase E的假定底物结合位点分离出另一个显性突变,当作为辅助质粒提供时,该突变进一步提高了蛋白质产量。这使得改进其他BL21变体变得容易,并指出RNA酶是细胞工厂优化的主要目标。
蛋白质的重组生产使生化和结构研究成为可能,大肠杆菌菌株BL21(DE3)中的pET载体是研究实验室中最受欢迎的方法1。快速生长、高细胞密度、廉价培养、100多种pET表达载体的可用性2以及对大肠杆菌遗传学、生理学和代谢的详细了解,使其成为首选的实验室载体。3这一点从引用pET载体用途的200,000多份研究出版物中可以明显看出,目前蛋白质数据库中超过128,000种(86%的重组体)结构以及全球生产的用于研究和商业用途的大约一半蛋白质都是在大肠杆菌中产生的2,4。尽管细菌在用于蛋白质生产时经常表现出生长受损和适应性丧失,这是一个高度基因特异性的问题,我们仍然缺乏基因和细胞工厂优化的明确指导原则。
膜蛋白(MPs)是重要的药物靶标,并在基本细胞机制中发挥重要作用。在原核生物和真核生物中,20–30%的基因编码膜蛋白。膜蛋白参与基本机制,如营养物质和信号分子的运输、对环境变化的响应、膜稳定性、氧化还原电位的维持、防御和能量转化。由于天然丰度通常太低,无法分离足够的材料用于体外研究,结构和生物化学研究受到我们在功能状态下重组生产和纯化膜蛋白的能力的限制。
众所周知,MPs还会给表达系统带来负担。它们需要正确地插入膜中,并且不能在包涵体中产生。这通常导致膜转位机制过载,并且先前已经报道严重阻碍细胞质中的蛋白质稳态,导致蛋白酶、伴侣蛋白和过度表达的MPs聚集。此外,对膜有限空间的竞争导致关键呼吸链复合物水平下降和Arc双组分系统上调,表明中枢代谢发生了严重变化。
解决基因表达负担的一个办法很简单:任何降低重组基因表达的突变都会提供一个选择优势。先前进化BL21(DE3)以获得更好的蛋白质产量的尝试已经反复证明了这一点。DE3菌株携带受lacUV5启动子控制的T7 RNA聚合酶(RNAP)基因,lacu V5启动子是用IPTG诱导的天然lacZ启动子的更强版本。这允许任何感兴趣的基因在T7启动子的控制下表达。已经分离了不同的菌株,其中膜蛋白生产的毒性降低,导致产量提高:Walker菌株C41(DE3)和C43(DE3)11,在20世纪90年代晚期进化为耐受膜蛋白的过量生产,最近表征的衍生物mutant5612进化为毒性膜蛋白YidC的更高生产,并且菌株C44(DE3)和C45(DE3)13类似地进化。在所有这些情况下,IPTG诱导的基因表达在突变发生之前抑制了琼脂平板上的菌落形成,并且获得了耐受性,这主要是由于T7 RNAP活性降低,或者通过lacI突变14,或者通过T7 RNAP基因中的启动子修饰、点突变或截短。
在这里,我们旨在了解更多关于基因表达负担的信息,希望通过在三个不同水平上限制进化解决方案空间来分离BL21(DE3)基因组中新类型的突变:我们删除了已知经常与BL21(DE3)中λDE3溶原重组的基因组同源区,我们将毒性基因的表达与绿色荧光蛋白(GFP)和抗生素抗性基因的表达偶联,我们允许在诱导毒性基因表达之前形成细菌菌落,并在一周的孵育期内分离突变体。
BL21(DE3)生产毒性蛋白的有限进化
在DE3菌株中,强的lacUV5启动子驱动T7 RNAP的表达,并且先前显示lacUV5和较弱的野生型lac启动子之间的同源重组是主导事件,其在引入毒性基因的数小时内导致BL21(DE3)15中的耐受性。为了防止这种情况,我们首先对BL21(DE3)进行遗传限制,通过精确删除与λDE3基因座具有同源性的天然lac基因座部分,产生lacI lacZ变体(图1)。此外,这将阻止编码乳糖通透酶的lacY的表达,允许IPTG更均匀、浓度依赖性地进入细菌群体中的所有细胞。
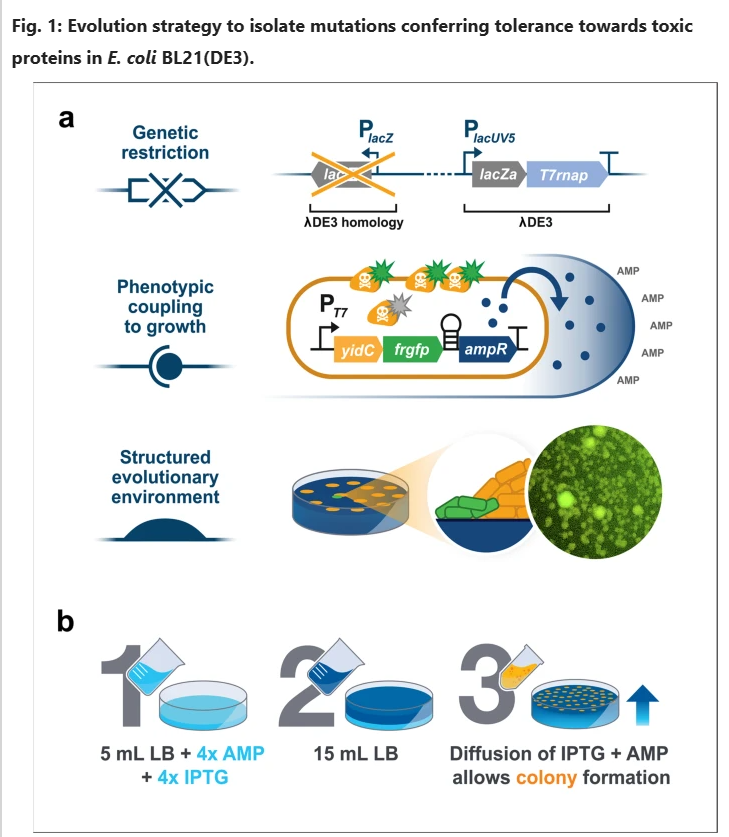
图1 a 显示用于限制BL21(DE3)的进化空间以在三个水平上克服蛋白质生产毒性的实验设置的图示:(上图)通过删除BL21(DE3)基因组中经常重组并降低T7 RNAP表达的部分来实现遗传限制,(中图)蛋白质生产与荧光和抗生素抗性相结合以防止非生产突变体的形成,(下图)设计老化细菌菌落的时空结构环境以鉴定强表型突变体。b .生产分层琼脂平板的工作流程示意图,该平板允许抗生素氨苄青霉素(AMP)和诱导剂IPTG扩散,从而在诱导毒性蛋白产生之前,允许在琼脂顶层表面上有足够的时间形成菌落。
接下来,类似于之前的研究,我们选择了与GFP偶联的大肠杆菌膜蛋白插入酶YidC作为模型蛋白,以研究由膜蛋白过量生产引起的应激,因为它以前被证明对大肠杆菌具有强烈的负适合度效应。GFP融合对于表型限制来说很方便,因为它允许对仍然产生融合蛋白的突变体进行视觉筛选。我们通过在表达质粒中引入发夹结构来进一步限制进化解决方案空间,该结构将YidC-GFP与β-内酰胺酶基因19的表达偶联,从而提供对氨苄青霉素的抗性(图1)。这样,在抗生素存在的情况下,非生产群体的形成应该被最小化。
最后,与之前的研究相反,我们的目的是在平板上建立细菌菌落后引入蛋白质生产压力。这种时空不同的方法应该允许大量细菌在休眠状态和结构化环境中形成,这在以前被证明构成了独特的进化环境。此外,我们推测突变体将很容易被鉴定为荧光次级菌落,即所谓的乳头,从最初建立的菌落中长出。为此,倾倒双层琼脂平板,允许IPTG和氨苄青霉素从底层向顶层缓慢扩散,以在诱导YidC-GFP产生之前给予菌落形成足够的时间(图1)。
在37°C下孵育1周期间,我们观察到几个荧光乳头(图1 ),它们被重新划线以证实荧光和氨苄青霉素抗性表型。基于荧光表型,使用温和且简单的基于CRISPR的质粒清除方法22,分离并清除了YidC-GFP质粒的最有希望的突变菌株。随后用原始YidC-GFP质粒再次转化这些菌株,以确保导致耐受性的突变位于基因组上,而不是表达质粒上。选择单个克隆(Evo21(DE3))用于进一步表征。
鉴定Evo21(DE3)蛋白质生产能力
为了对Evo21(DE3)进行基准测试,我们将其产生YidC-GFP融合蛋白的能力与未进化的BL21(DE3)野生型菌株以及之前描述的为YidC-GFP过量生产而优化的衍生Mt56(DE3)进行了比较12。质粒pLysS用于限制BL21(DE3)和Evo21(DE3)中基础T7 RNAP表达23。由于该菌株中聚合酶活性大大降低,pLysS在Mt56(DE3)中的共表达是不相关的。在液体培养中,基于GFP荧光,Evo21(DE3)比BL21(DE3)和Mt56(DE3)表达显著(P ≤ 0.0001)更高量的YidC-GFP。诱导后8小时,Evo21(DE3)培养物的产量比BL21(DE3)培养物高3.6倍,比Mt56(DE3)高2.1倍(图2a)。平行监测培养物的光密度显示菌株没有重大的生长损害(补充图1)。
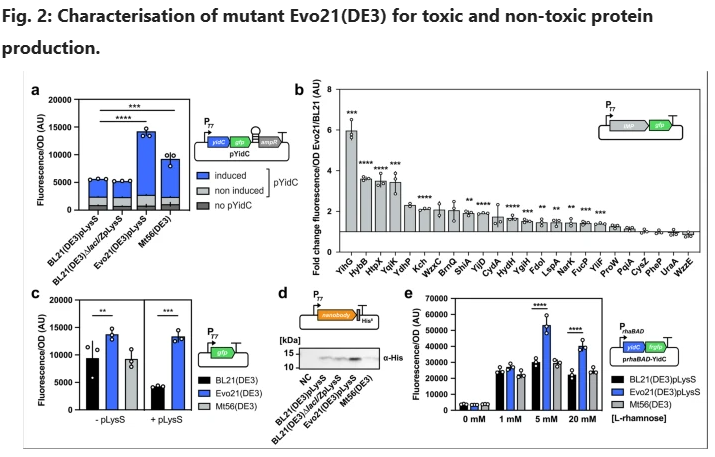
为了评估Evo21(DE3)表型是否是基因特异性的,我们接下来研究了选自大肠杆菌内膜蛋白质组24的表达载体文库的一组24种不同GFP融合蛋白的表达。选择这些膜蛋白以涵盖广泛的功能、毒性(之前报道为IPTG加成后OD600的变化24)和预测的跨膜结构域数量(补充表1)。比较Evo21(DE3)和BL21(DE3)中蛋白质生产的倍数变化,24种蛋白质中的19种的滴度提高了——其中14种的显著倍数变化超过1.5倍(图2b)。在蛋白质YihG中观察到的最高改善是6.1倍(P ≤ 0.001)。
作为允许Evo21(DE3)产生更多毒性蛋白的潜在机制与T7表达系统活性的总体下降无关的第一项测试——正如先前对BL21(DE3)衍生物C41/43(DE3)、C44/45(DE3)和Mt56(DE3)观察到的那样——我们Sanger对T7 RNAP基因进行了测序,这证实了不存在突变。接下来,我们比较了两种无毒可溶性蛋白GFP和骆驼源纳米抗体的表达,在存在和不存在pLysS的情况下,这两种蛋白在Evo21(DE3)中的表达水平都高于BL21(DE3)或Mt56(DE3)中的表达水平(图2c,d)。类似地,Evo21(DE3)在八种不同植物来源的细胞色素P450酶中的七种的产量方面优于其他菌株,这是一类具有重大生物技术意义的酶25(补充图2)。这表明Evo21(DE3)中的致病突变不同于以前分离的BL21(DE3)衍生物,并且可能不会引起T7 RNAP活性的普遍降低。
即使用高效的T7系统进行蛋白质生产率提高的筛选,理想的突变菌株也能够不依赖于启动子系统而产生更多的蛋白质。为了探索Evo21(DE3)是否是这种情况,我们在yidC-GFP表达载体中用l-鼠李糖诱导型rhaBAD启动子替换T7启动子,将其转化到Evo21(DE3)中,并通过在液体培养中用不同鼠李糖浓度诱导来表达该构建体。在5和20mM l-鼠李糖浓度下,Evo21(DE3)比BL21(DE3)和Mt56(DE3)产生显著(P ≤ 0.0001)更多的蛋白质(图2e)。
总之,这种最初的特征表明,进化的菌株可以使用T7系统非依赖性机制产生一系列不同蛋白质的更高滴度。