023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


背景
长非编码RNA在许多生理和病理过程中发挥重要作用,这表明长非编码RNA可以作为基因治疗的潜在靶点。稳定表达是研究lncRNAs的基础技术。慢病毒是用于稳定表达的最广泛使用的递送系统之一。然而,它最初是为mRNAs设计的,慢病毒载体对lncRNAs的适用性在很大程度上是未知的。
结果
我们发现慢病毒载体产生带有不适当终止的lncrnas,在3ʹ-end.上附加一个大约2 kb的额外片段因此,在某些lnc RNA中,二级结构改变,RNA蛋白质相互作用受阻,功能受损,这表明慢病毒载体不是lnc RNA的理想递送系统。在这里,我们开发了一种新的lncRNA递送方法,称为利用转座子系统表达具有内源性特征的ln crna。通过在lncRNA序列后插入终止信号,ELECTS产生了没有3ʹ-flanking序列的转录物,并保留了ln crna的天然特征和功能,这是慢病毒载体所不能实现的。此外,ELECTS不会给操作人员带来潜在的感染风险,而且耗时更短。elections为lncRNAs的稳定表达提供了可靠、方便、安全和有效的递送方法。
结论
我们的研究表明,慢病毒载体的不适当转录终止对lncRNAs的分子作用和细胞功能有根本影响。本研究建立的ELECTS系统将为lncRNA的研究提供一种方便可靠的方法。
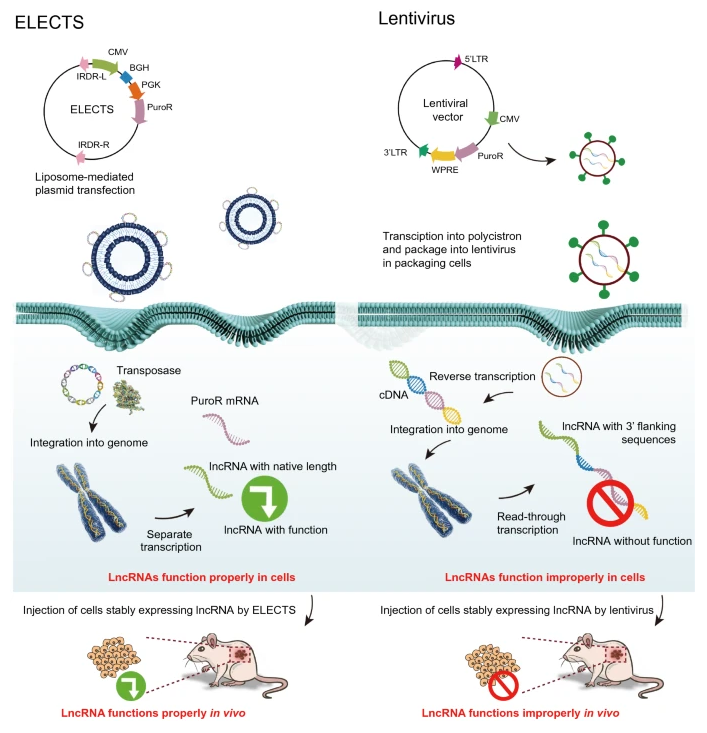
背景
长非编码RNA是一种长度超过200个核苷酸的RNA,没有明显的蛋白质编码潜力。通过与蛋白质、DNA和RNA相互作用,lnc RNA在各种生物和病理过程中发挥重要的调节作用。随着高通量测序技术的发展,越来越多的lncRNAs被鉴定出来,但是其中只有一小部分被进行了功能研究。lncRNAs与各种纳米材料的结合为癌症治疗提供了新的策略。
慢病毒是lncRNAs稳定表达最常用的工具。正如最初为蛋白质编码基因设计的那样,邻近克隆位点的复杂3ʹ-flanking序列被设计用于有效的病毒颗粒生产和基因表达。此外,据报道,来自LTR-逆转录转座子/逆转录病毒的某些转录物也可以像lncRNA一样起作用,这可能为使用慢病毒递送lnc RNA产生副作用。因为mRNA翻译终止于终止密码子,所以附着于靶序列的载体的3ʹ-flanking序列对蛋白质产物几乎没有影响。相比之下,lnc RNA在RNA水平发挥作用,一级序列、长度和二级结构都是lnc RNA性质的关键因素。然而,作为一个潜在的问题,3ʹ-flanking序列是否影响lncRNA的功能长期被忽视。在这里,使用传统的慢病毒载体,我们过表达了6个功能有效的lncRNAs。令人惊讶的是,他们中的四个未能再现先前报道的表型。对HCCL5和HOTAIRM1的进一步研究表明,由慢病毒载体表达的lncRNAs与侧翼的慢病毒元件一起转录,导致比其内源版本长得多(> 2 kb)的转录物。这些结果表明慢病毒可能不适合某些lncRNAs。侧翼慢病毒元件可以改变RNA二级结构,减少RNA-蛋白质相互作用,并损害lncRNAs的功能。由于转录和逆转录是逆转录病毒繁殖所必需的,转录终止信号不能插入两个长末端重复序列(LTRs)之间。因此,lncRNA的精确转录终止不能通过慢病毒载体实现。
DNA转座子是稳定表达和基因治疗的另一个理想系统。与逆转录病毒不同,DNA转座子载体的整合不需要转录。在这里,我们开发了一种新的非病毒递送系统,称为利用转座子系统(ELECTS)表达具有内源性特征的lnc RNA,该系统表达没有侧翼序列的lnc RNA,并保留几乎与内源性lnc RNA相同的长度。此外,使用脂质体或其他纳米颗粒来递送lncRNAs,ELECTS不需要病毒包装或感染过程。一方面,操作者没有潜在的感染风险,另一方面,它比慢病毒载体更省时。选举只需要1周,而慢病毒需要大约2周才能成功获得稳定表达细胞(表1)。因此,我们的选择为lncRNAs的稳定表达提供了可靠、安全和有效的方法。
我们的研究表明,慢病毒载体的不正确转录终止对lncRNAs的分子作用和细胞功能具有根本影响,这一点非常重要,但经常被研究人员忽视。我们的研究将为lncRNA研究者群体提供一个方便可靠的稳定表达系统。
慢病毒载体表达lncRNA的性能
由于慢病毒的复制和整合需要转录和反转录,转录终止信号或聚腺苷酸位点在目的基因后不存在。理论上,lncRNA可以与所有下游元件一起转录成一个长而复杂的转录物,这可能影响ln crna的功能。为了检验这一假设,我们根据以下标准选择了6个lnc RNA:(1)短于1000 nt,因为我们认为核苷酸较少的lnc RNA更可能受侧翼序列的影响;(2)已经证明使用pCDNA3/3.1载体影响细胞增殖(图1A)。我们使用pCDH(一种广泛使用的商业慢病毒载体)在HepG2细胞中表达这些lncRNAs。lncRNAs的表达水平通过qRT-PCR分析进行评估(图1B)。令人惊讶的是,尽管所有这些lncRNAs都已成功过表达,但通过集落形成试验测定,其中四种lncRNAs没有显示出细胞增殖的显著变化(图1C)。

设计一种允许具有内源性特征的lncRNAs稳定表达的方法
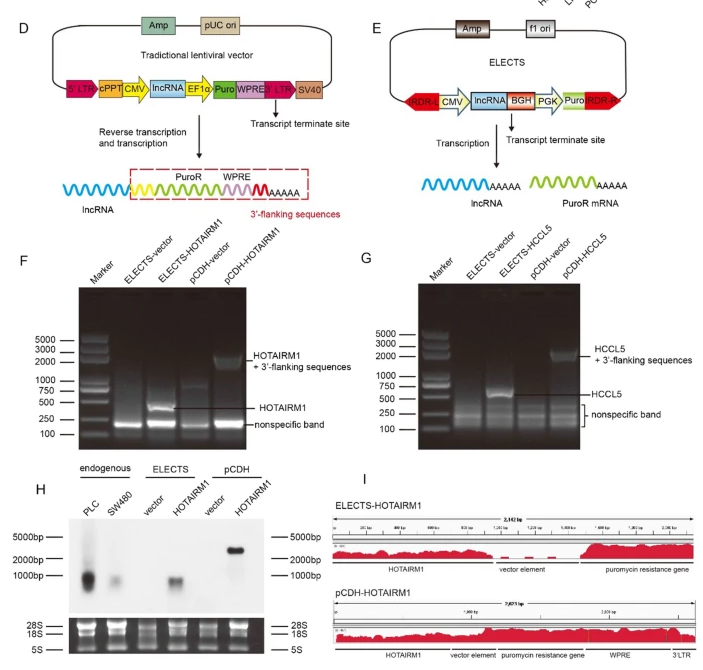
转录终止信号或poly (A)位点可以将lncRNA转录物与载体元件分离。然而,如上所述,转录终止信号或poly (A)位点将破坏整个病毒RNA的逆转录,并显著降低病毒的滴度,这对于通过慢病毒载体表达lncRNAs来说是一个难题。
为了解决慢病毒载体引起的问题,我们试图开发一种利用转座子载体稳定表达lncRNAs的工具。我们使用pSB质粒,一种在我们以前的研究中使用的SB转座子[17,23],来构建用于过量表达lncRNAs的质粒。pSB质粒的原始CAG启动子包含鸡β-肌动蛋白基因的第一个外显子和第一个内含子,其将与目的序列一起作为5ʹ-flanking序列的一部分被转录,因此我们用CMV启动子替换了CAG启动子。我们还从载体中移除了氯霉素抗性基因和Gateway盒(附加文件1:图S1A)。然后,我们插入了一个多克隆位点(MCS),随后是牛生长激素聚腺苷酸化信号(BGH polyA) [24],它可以有效地终止紧接在lncRNA序列之后的转录(图1E)。GFP和嘌呤霉素抗性基因的转录由独立于lncRNA转录的PGK启动子驱动。我们还使用ELECTS在HepG2细胞中表达了这些选择的lnc RNA,并通过qRT-PCR分析测试了lnc RNA的表达水平(附加文件1:图S1B)。集落形成试验显示,由ELECTS表达的外源lncRNAs促进细胞生长,但由pCDH表达的lncRNAs不促进细胞生长(附加文件1:图S1C)。虽然GFP可用于评估转染效率(附加文件1:图S1D)和异种移植肿瘤,但它可能影响FISH或免疫荧光的应用。因此,我们构建了两个版本的质粒,一个带有GFP,一个没有(delGFP)。
因此,在选择中,lncRNA基因的转录由CMV启动子启动,由BGH poly (A)信号终止,选择标记盒由独立的PGK启动子驱动。上述所有元件的侧翼是SB转座子的IRDR-L/R,其被SB转座酶识别(方案1)。当用SB100X表达质粒共转染时,SB IRDR-L/R之间的盒将被切割并整合到宿主细胞的染色体中,导致lncRNAs的稳定表达。还可以用SB11表达质粒(Addgene,#26552)(一种活性较低的转座酶)共转染选举细胞,以实现中度过表达(附加文件1:图S1E,F)。
慢病毒载体表达具有3ʹ-flanking序列的lnc RNA,而转座子系统产生具有适当终止的lnc RNA
我们推测pCDH和ELCETS诱导的表型差异可能是由于外源lncRNAs的不同特性。pCDH中缺少终止信号可能导致3ʹ末端出现额外的序列。为了测试这个假设,我们从上面选择了2个lncRNAs,HCCL5和HOTAIRM1,用于进一步的研究。使用pCDH载体成功获得稳定表达细胞需要大约2周,但是使用ELECTS载体只需要大约1周,表明ELECTS是一种省时的方法(表1)。
分离通过两种载体稳定过表达lncRNA的HepG2细胞的总RNA,并进行3ʹ RACE分析以检测lnc RNA的3ʹ末端序列。由选举表达的lnc RNA显示出几乎与预期相同的3ʹ末端长度,而由pCDH表达的lnc RNA显示出比预期大得多的条带(图1F,g)。3ʹ RACE的测序结果显示仅有165 bp的克隆位点,并且部分BGH序列位于所选表达的lncRNA的3ʹ末端的侧翼(附加文件3:表S2)。然而,由pCDH表达的lncRNA在3ʹ末端显示了一个1976 bp的额外片段,包含克隆位点、EF1α启动子、嘌呤霉素抗性基因、WPRE和3ʹ末端的部分LTRs(附加文件3:表S2)。
为了进一步证实这一现象,我们通过northern印迹分析了HOTAIRM1转录物。我们使用了两种细胞系,PLC和SW480,它们具有相对高水平的内源HOTAIRM1表达,作为内源HOTAIRM1在凝胶上位置的对照。选举表达的HOTAIRM1的大小约为900 bp,几乎与内源HOTAIRM1的长度相同,而pCDH产生的HOTAIRM1的大小约为2.8 kb,约为前者的三到四倍(图1H)。此外,我们使用HepG2稳定细胞进行了RNA-seq。来自pCDH的lncRNA转录物是“通读的”,导致长的和不适当的转录物异构体。转座子系统中的靶基因和选择基因的元件被分别转录,但lncRNA转录物的长度等于内源的长度(图1I),这与northern印迹结果一致。
综上所述,该数据揭示了ELECTS成功转录了长度基本上与内源转录物相同的lnc RNA,同时通过慢病毒载体将一大段序列附加到lnc RNA上(图1D),其甚至比lnc RNA本身长得多。
转座子系统保留lncRNA的促增殖表型,而慢病毒系统表达的Inc RNA该功能缺失
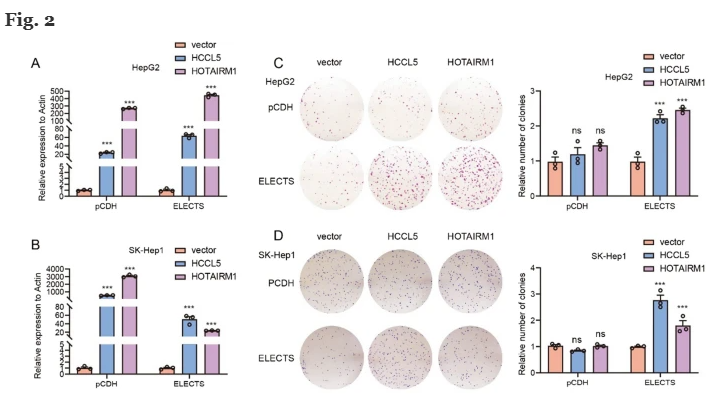
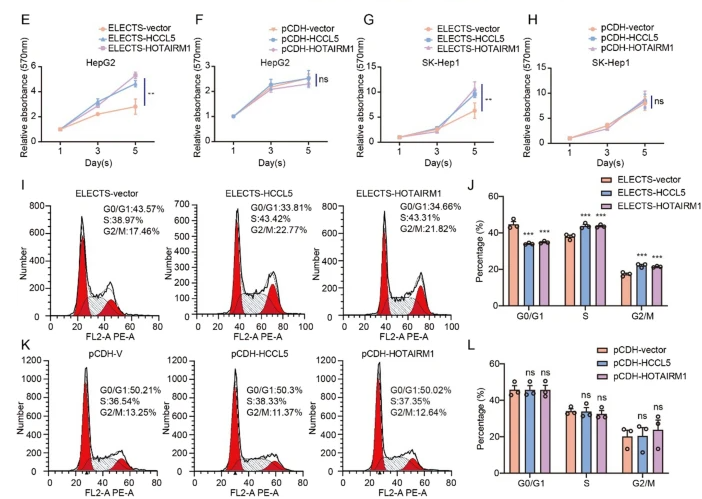
为了详细测试选举载体的性能,分离总RNA并进行qRT-PCR分析以评估lncRNAs的表达水平。在HepG2中分别使用ELECTS和pCDH,观察到HOTAIRM1上调约400倍和250倍。对于HCCL5,使用ELECTS和pCDH的过表达水平分别约为50倍和25倍(图2A)。选举显示了比pCDH稍高的表达水平。而在SK-Hep1细胞系中,pCDH的过表达效率略高于ELECTS(图2B)。
HCCL5是一种lncRNA,可促进肝细胞癌中的肿瘤发生,并参与促进细胞生长和转移[18]。HOTAIRM1作为癌基因在多种类型的癌症中发挥作用[19,20,25,26]。这些lncRNAs的促增殖功能已经在以前通过使用pcDNA3/3.1载体的过表达实验得到了证实。为了研究不同载体表达的外源性lncRNA的功能,我们通过集落形成和MTT试验来评估细胞增殖。通过选举稳定过表达HCCL5和HOTAIRM1的细胞显示出增殖的显著增加,而通过集落形成(图2C,D)和MTT测定(图2E–H)显示出pCDH过表达这些lncRNAs对细胞生长没有影响。
我们通过流式细胞仪进一步检测了lncRNA对细胞周期的影响,当转座子过表达HCCL5和HOTAIRM1时,HepG2细胞中S期和G2/M期细胞的数量显著增加,而当用pCDH表达lnc RNA时,没有观察到细胞的显著变化(图2I–L)。EdU试验也用于通过测量处于S期的细胞比例来确认细胞增殖率的变化。在转座子表达lncRNA HCCL5和HOTAIRM1的细胞中,S期细胞的比例因选举而增加,但慢病毒则不增加(图3A-D)。我们还检测了细胞周期蛋白家族的表达水平,该家族作为CDK激酶的调节因子,调节细胞周期的进程。CCNA1调节S期和G2期的转换,CCNB1调节G2/M期转换,CCND1调节G1/S期转换。在通过转座子稳定表达HCCL5和HOTAIRM1的细胞中,这些蛋白质的表达水平高于对照细胞,而在通过慢病毒载体在HepG2或SK-Hep1细胞中表达这些lncRNAs后,没有观察到蛋白质水平的明显增加(图3E,F)。这些结果表明,尽管慢病毒载体和转座子可以实现HCCL5和HOTAIRM1的有效过表达,但只有转座子表达的lnc RNA保留了功能,慢病毒lnc RNA不能再现pcDNA3/3.1以前观察到的功能。
转座子而非慢病毒载体表达的异位HCCL5增强细胞迁移
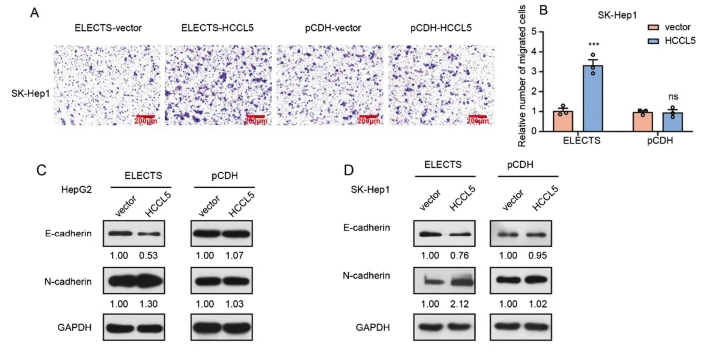
先前对lncRNA HCCL5的研究也表明,它可以通过促进上皮-间质转化(EMT)和癌细胞的转移来发挥癌基因的作用。我们进一步研究了lncRNA对不同过表达系统迁移率的影响。Transwell试验显示,通过转座子外源表达lncRNA HCCL5可以促进细胞迁移,而通过pCDH稳定表达HCCL5的细胞没有显示迁移优势(图4A,B)。我们还通过Western Blot测量了EMT标记的表达水平,使用转座子在过表达HCCL5的SK-Hep1和HepG2细胞中观察到E-钙粘蛋白的下调表达水平和N-钙粘蛋白的上调表达水平(图4C,D ),但是当通过慢病毒载体表达时没有发现显著变化。这些数据表明,转座子过表达的lncRNA HCCL5可以通过促进EMT过程,显着促进体外细胞迁移,而慢病毒表达的Inc RNA不能。
通过转座子而非慢病毒载体表达的异位HOTAIRM1促进体内异种移植物的生长
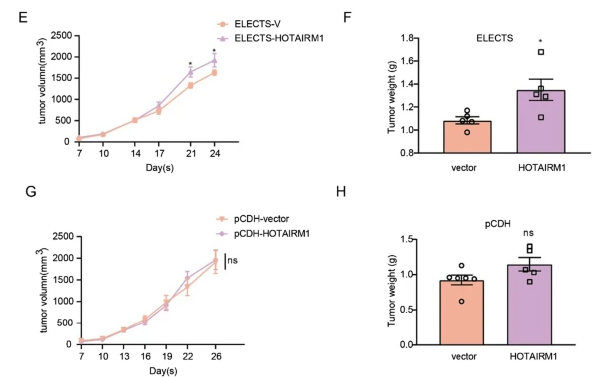
稳定过表达通常用于需要长期观察的lncRNA功能的研究,最常见的应用之一是使用异种移植肿瘤研究体内功能。为了测试不同载体表达的外源lncRNA是否能在体内发挥作用,将通过选择或慢病毒载体稳定表达HOTAIRM1的SK-Hep1细胞皮下注射到裸鼠中以形成异种移植瘤。对于由选举过度表达的HOTAIRM1,肿瘤体积和重量显著高于对照组(图4E,F,附加文件1:图S2A)。然而,当通过慢病毒载体表达时,稳定表达HOTAIRM1的细胞和对照组之间的肿瘤体积和重量没有差异(图4G,H,附加文件1:图S2B)。
慢病毒载体侧翼序列影响lncRNAs的二级结构
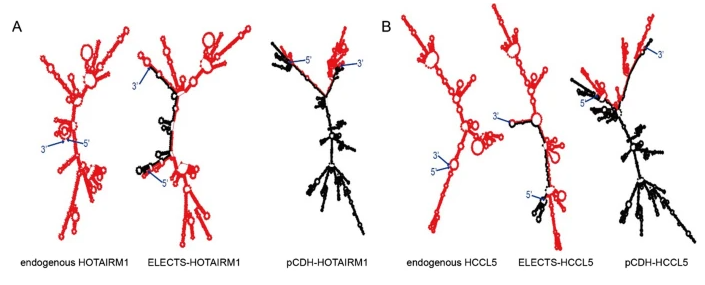
二级结构对于lncRNAs的作用至关重要,RNA结构似乎是主要的功能单位,并且在进化上更为保守[1,27]。为了研究来自载体的额外元件对二级结构的潜在改变,我们使用RNAfold [28]进行了二级结构分析,RNAfold是一种广泛用于预测RNA二级结构的网络服务器。通过比较天然lnc RNA、由ELECTS和pCDH表达的lnc RNA的预测结构,我们发现ELECTS表达的HOTAIRM1和HCCL5的二级结构与天然转录物的基本相同,而由pCDH表达的lnc RNA显示出实质上不同的二级结构(图5A,B)。pCDH表达的lnc RNA的结构变化主要是由lnc RNA与载体侧翼序列之间丰富的碱基对引起的。此外,慢病毒侧翼序列也形成复杂的结构,这也可以重塑lncRNAs的整体结构。
来自慢病毒载体的侧翼序列损害RNA蛋白质相互作用
由于lnc RNA通常通过与蛋白质相互作用发挥功能,我们接下来研究了侧翼序列是否干扰lnc RNA和蛋白质之间的相互作用。据报道,HOTAIRM1通过与SUZ12(一种多梳抑制复合物2 (PRC2)成分)相互作用来调节某些基因的表达[29]。为了检测RNA-蛋白质相互作用的强度,使用SUZ12抗体免疫沉淀稳定表达HOTAIRM1的细胞,并通过RT-PCR (RIP-qPCR)检测相关的RNA。由ELECTS表达的HOTAIRM1显示出比由pCDH表达的高得多的SUZ12亲和力(图5C,D)。我们使用RNA下拉分析进一步评估了这种相互作用。根据3ʹRACE的结果,在体外合成对应于由ELECTS和pCDH产生的HOTAIRM1转录物的不同RNA,并且等量的生物素标记的RNA与细胞裂解一起孵育。蛋白质印迹显示,由短转录物拉低的蛋白质有强的SUZ12带,而由长转录物富集的蛋白质中没有检测到SUZ12(图5E,F)。这些数据表明,由慢病毒载体引入的侧翼序列削弱了lnc RNA-蛋白质的相互作用。
正确的终止信号对于某些lncRNAs的功能至关重要
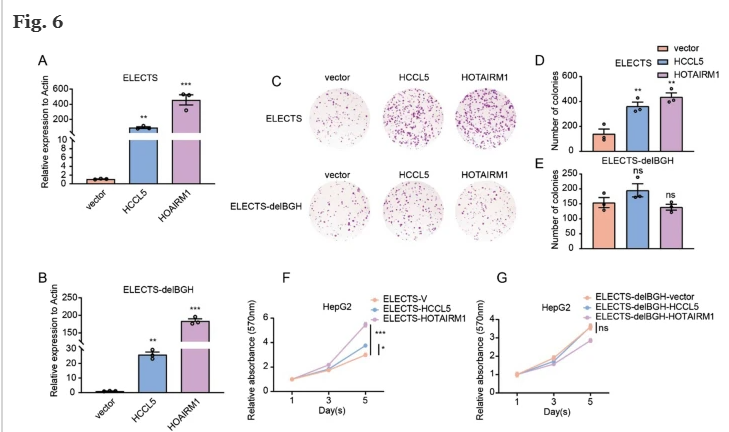
进一步评估适当终止对lncRNAs的重要性。我们从转座子载体中删除了BGH序列,该序列有助于有效终止lncRNA序列3ʹ末端的转录,产生了一个新的载体,命名为elections-delBGH。正如预期的,northern印迹显示,由elections-del bgh产生的转录物显示出比由elections产生的转录物长约2500 bp的额外条带(额外文件1:图S2C)。还使用如上所述的RNAfold分析了转录物的二级结构,并且当下游元件用lncRNAs转录时,发现了二级结构的基本变化(附加文件1:图S3)。进行了各种试验来检测这些外源lncRNAs的功能。尽管ELECTS-delBGH,像慢病毒载体一样,可以有效表达lncRNAs(图6A,B),集落形成试验(图6C–E),MTT试验(图6F,G)显示当HCCL5或HOTAIRM1过表达时没有生长优势。EdU(图6H)和流式细胞术分析(图6I)也显示,过度表达HCCL5或HOTAIRM1而不适当终止不会导致细胞周期的明显变化。这些数据表明,由于不适当的终止,额外的相邻序列可以取消lncRNAs的功能。
讨论
稳定表达是研究lncRNAs生物学作用和机制的基础技术。稳定表达的策略主要包括(1)随机整合策略;(2)成簇的规则间隔的短回文重复激活(CRISPRa)和(3)基于慢病毒的系统。pcDNA3/3.1等瞬时表达载体能以低频率随机整合到宿主基因组中。然而,随机整合可能导致目的基因的不完全插入和细胞间高度异质性的表达水平,通常需要克隆选择。此外,由于整合频率低,这相当耗时,建立一个稳定的细胞可能需要长达6个月[30,31]。CRISPR通过与dCas9融合的转录激活域(如VP64)激活内源性基因过表达。尽管保留了lncRNA的许多内源性特征,但据报道,三分之二的lnc RNA是反义RNA和/或与邻近基因共享相同的启动子。使用CRISPRa过度表达lncRNAs可能导致相邻基因的不希望的扰动,这可能导致表型的错误鉴定,而事实上这可能归因于其他基因。
高效的感染和整合使得逆转录病毒,尤其是慢病毒成为最广泛使用的稳定表达系统。如今,越来越多的lncRNAs过表达实验是使用慢病毒载体进行的。然而,病毒载体可用性背后的一些重要挑战仍然存在。我们强调了lncRNA表达的主要限制之一是载体引入的额外序列可能影响某些ln crna的天然功能。在本研究中,作为例子,我们发现lncRNAs、HCCL5、HOTAIRM1、LINC00364和PCBP2-OT1(已报道使用pcDNA3/3.1促进癌细胞生长)在用慢病毒载体pCDH表达时不能发挥相同的作用。
我们选择HCCL5和HOTAIRM1进行详细研究。在使用慢病毒载体在两种不同的细胞系中成功过表达lnc RNA后,我们进行了3ʹ RACE、Northern印迹和RNA-seq实验,并证实了慢病毒载体表达的lnc RNA的长度确实比天然版本长得多,其序列也更复杂。各种功能研究表明,从pCDH载体表达的lncRNAs不能正确发挥功能,既不能促进细胞增殖,也不能增加细胞迁移。进一步的研究还表明,具有额外序列的lncRNAs的二级结构被改变,因此RNA蛋白质相互作用被削弱。
避免侧翼序列在3ʹ末端连接靶序列的一种可能方法是将表达盒放在慢病毒载体序列的负链上,这样poly (A)信号就不会干扰慢病毒的转录和复制。然而,来自5ʹ-UTR的转录本将包括lncRNA的反义版本,使得情况更加复杂。
此外,慢病毒载体整合本身可以对宿主细胞的基因表达产生巨大影响,例如通过通读转录产生包含载体序列和细胞mRNAs的嵌合融合转录物[35,36]。
相比之下,DNA转座子的生命周期要比逆转录病毒简单得多。它可以有效地将供体序列整合到宿主基因组中,无需转录过程。在这里,我们开发了基于SB转座子的lncRNAs表达载体ELECTS。通过在lncRNA基因后添加BGH poly (A)序列,我们表达的lncRNA转录物的长度几乎与内源版本相同,并且ln crna的天然二级结构在很大程度上得以复制。更重要的是,与相关的RBP和细胞学功能的相互作用也得到很好的保留。SB的反向重复序列(IR)很短,不含启动子或增强子元件,如逆转录病毒的LTRs转座子对宿主细胞的影响也比逆转录病毒弱。
当然,这并不是说慢病毒载体不能用于lncRNA基因的表达。实际上,已经使用慢病毒载体成功地进行了许多关于lncRNA的功能研究[37,38,39],这可能有几个原因:(1)lnc RNA序列相当长,因此额外的片段只是整个转录物的一小部分。(2)lnc RNA的主要功能区远离3ʹ额外序列。(lncRNA在细胞质中起作用,但不在细胞核中起作用。可能需要进行进一步的调查来评估这些原因。然而,考虑到使用慢病毒载体的潜在副作用,基于慢病毒过量表达的lncRNA研究得出的一些结论可能需要重新考虑。
此外,慢病毒载体具有插入大小的限制。当插入片段过大时,病毒纳米颗粒的包装效率急剧下降,但转座子载体几乎没有插入大小限制。对于非常大的lncRNAs的表达,ELECTS无疑优于慢病毒载体。与慢病毒载体不同,转座子载体对操作者没有潜在的感染风险,这是一种无危险的方法。
此外,当用于基因治疗时,由慢病毒载体引入的额外序列也是潜在的问题。考虑到转座子载体在表达lncRNAs方面的优势,并且SB载体是基因治疗中的成熟系统,SB或其他类似系统可能是比慢病毒载体更好的治疗递送选择。
在纳米生物技术领域,非病毒传递,尤其是基因传递,引起了科学家和研究人员的关注。许多有效的、生物相容性好的给药载体被开发出来,克服了诸如给药效率低、缺乏细胞特异性、稳定性差和细胞毒性高等障碍,促进了纳米技术在生物医学研究中的发展和应用。
尽管已经开发了许多新的递送载体来促进质粒DNA进入细胞,但是靶基因的许多特征,例如序列特征、长度和调节元件,是由表达质粒决定的。因此,合适的质粒和有效的载体对于基因传递的成功都是至关重要的。随着越来越多的研究表明lnc RNA可以作为基因治疗的潜在靶点,开发新的lnc RNA递送策略引起了许多研究者的兴趣。然而,如何稳定表达lncRNA具有挑战性。在这项研究中,我们开发了一种基于转座子的基因表达系统,称为ELECTS,用于稳定表达lncRNAs或基因,并在很大程度上保留其内源长度、结构和功能。我们将商业脂质体用于质粒递送,只是为了说明选择可以产生具有内源性功能的lncRNA。在装载质粒之前和之后,纳米颗粒的流体动力学尺寸为约150 nm。大小与TEM结果一致。质粒、脂质体和装载有质粒的脂质体的ζ电势值为12.8 mV、28.8 mV和16.6 mV(附加文件1:图S4)。此外,我们的基因表达系统可以通过一系列纳米颗粒传递到细胞中,以实现靶向传递并在宿主细胞中正常发挥功能。新型纳米粒子与我们的选择相结合将促进生物学和纳米技术之间的对话,也将促进纳米生物技术在生物学研究和疾病治疗中的发展和应用。
结论
总之,我们报道lncRNAs的转录终止决定了它们的天然特性,并且在异位表达时对功能的正常发挥至关重要。来自慢病毒载体的额外序列可能改变某些lncRNAs的二级结构,并影响它们与RBP的相互作用。慢病毒载体不适合表达某些lncRNA,本研究中开发的ELECTS是一种高性能递送系统,可以满足lnc RNA研究的高效整合和高保真表达。