023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


MicroRNAs是转录后调节因子,控制mRNA的稳定性和靶基因的翻译效率。成熟的微小RNA大约有22个核苷酸长。它们通过结合靶mRNAs中的不完全互补序列(又名微小RNA调节元件,MRE)来介导转录后基因调节。据估计,人类基因组中超过三分之一的蛋白质编码基因受微小核糖核酸调控。检测miRNA和它在mRNA中的靶向位点之间的相互作用的实验方法对于理解miRNA的功能是重要的。荧光素酶报告基因测定法最近已被用于测试miRNA的作用。在这一章中,我们使用一个先前确定的位于RhoC mRNA 3′-非翻译区(3′-UTR)的miR-138靶向位点作为例子,来描述一种快速检测miRNA和mRNA相互作用的方法。
微小RNA(miRNAs)是内源性表达的单链非编码RNA(长度约20-24个核苷酸),几乎存在于所有真核细胞中。已经证明miRNAs调节许多发育和生理过程,并且miRNAs的失调与许多疾病过程相关(1,2)。miRNAs构成了一类重要的微调基因表达调节因子,被称为“二聚体开关”,因为它们能够抑制基因表达而不完全沉默。它们是转录后调节因子,与靶信使RNA转录物(mrna)上的不完全互补序列(又名miRNA调节元件,MRE)结合,通常导致翻译抑制和基因沉默(2)。动物miRNAs通常与3′-非翻译区(3′-UTR)的位点结合,而植物miRNAs通常与mRNAs的编码区结合。许多生物信息学工具可用于预测miRNA靶向序列(3)。然而,为了理解微小RNA在复杂生物学过程中的作用,重要的是通过实验评估预测的微小RNA靶向位点的功能相关性。
MicroRNA-138 (miR-138)已被证明可以调节许多重要的生物过程,包括乳腺的发育(4),树突棘形态发生的调节(5),胚胎发育期间心脏模式的调节(6)和耐热性获得(7)。在许多癌症类型中经常观察到miR-138的失调,包括甲状腺癌(8)、肺癌(9)、白血病(10)和头颈/口腔癌(11-15)。miR-138的下调与口腔癌细胞中RhoC表达增强以及细胞迁移和侵袭相关(12,16)。miR-138的靶向序列最近在RhoC mRNA的3′-UTR中被鉴定出来(图1) (12)。在这一章中,为了说明,我们将测试miR-138和它在RhoC mRNA的3′-UTR中的靶向序列的相互作用。
萤火虫荧光素酶通常被用作评估完整细胞中转录活性的报告基因。荧光素酶报告基因分析最常见的应用是检测启动子和转录因子对转录活性的调节。最近,这种方法也被用于检测miRNA介导的转录后调控对靶基因的影响。这是通过改造荧光素酶基因构建体来实现的,该构建体包含来自靶基因(通常位于3′-UTR)的预测miRNA靶向序列。对于许多人类基因,含有完整3′-UTR的荧光素酶构建体可以从许多商业来源获得(例如,OriGene Technologies,Inc,GeneCopoeia,Inc,和SwitchGear Genomics)。然而,3′-UTRs可能包含多个靶向序列和其他调控元件。需要特定的试验来测试每个miRNA靶向序列。在这一章中,我们描述了一种快速检测miRNA和特定靶序列相互作用的方法。我们还提出了一个简单的策略来创建作为阴性对照的突变构建体。
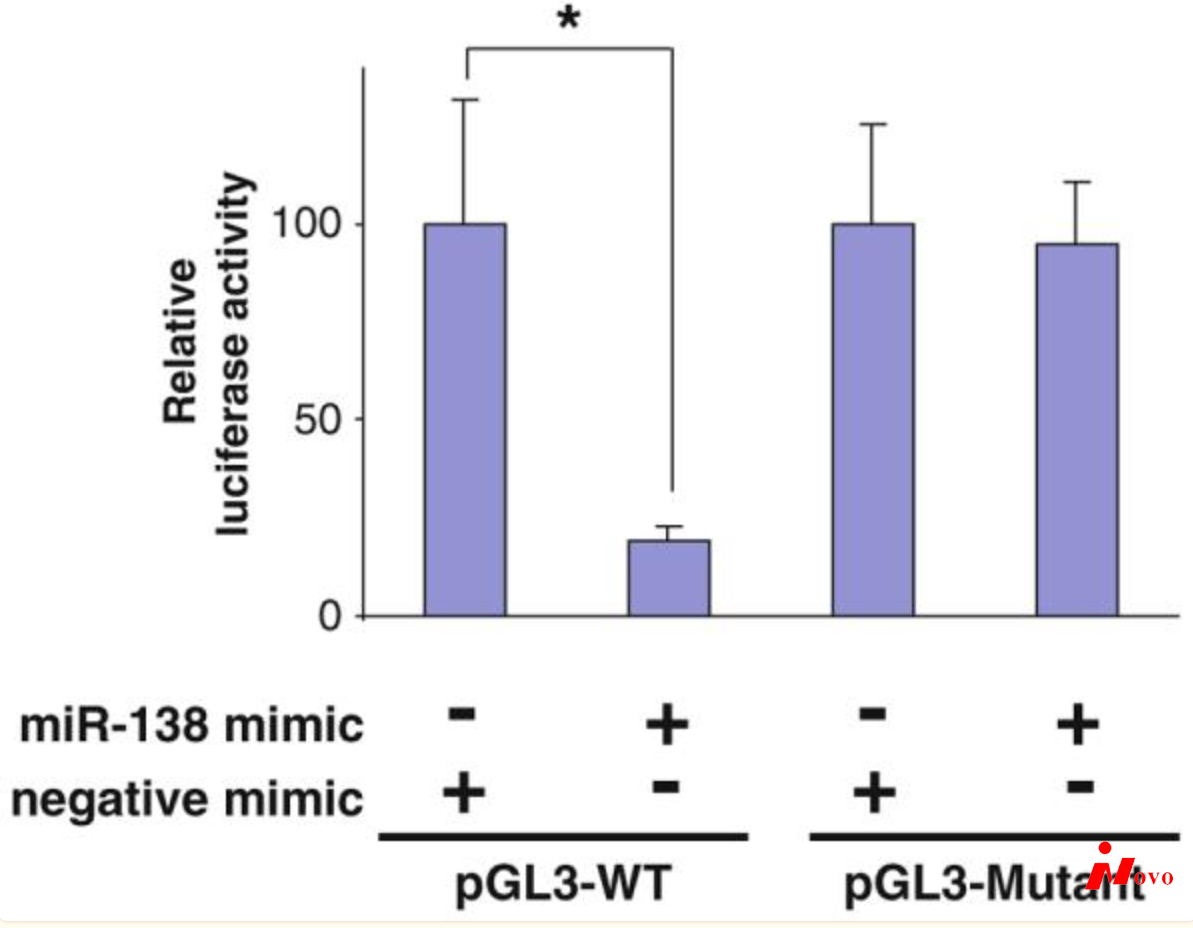
图1:MicroRNA-138通过位于3′-UTR的靶向序列靶向RhoC mRNA。进行双荧光素酶报告基因测定,以测试hsamiR-138及其靶向序列在RhoC 3′-UTR中的相互作用,使用的构建体包含克隆到报告基因3′-UTR中的预测靶向序列(pGL3-WT)和突变靶向序列(pgl 3-突变体)。数据代表三个独立的实验,三次测量。*表示p < 0.05。
要点:
1、作为阴性对照,我们通过用T(7)替换靶向位点的种子区域,创建了包含突变的hsa-miR-138靶向位点的报告构建体。用于产生突变报道基因构建体的其他策略也在各种研究中使用,包括仅突变与miRNA序列互补的碱基,突变整个miRNA靶向位点(例如,使用反向链),或删除种子区域。
2、由于XbaI位点是pgl 3-控制载体的3′-UTR上唯一可用的限制性酶切位点,因此在pgl 3-插入质粒中,插入片段可以有两个方向:正向插入序列和反向插入序列(理论上每个方向有50/50的机会)。值得努力在pgl 3-控制载体的3′-UTR上产生额外的限制性酶切位点。这样做将允许不同的酶位点被附加到合成的寡聚物的末端,并确保连接将处于正确的方向。这可以通过简单地将含有多个限制性酶位点的短寡核苷酸插入XbaI位点来实现。
3、因为我们仅使用一种限制性内切酶(XbaI)进行克隆,所以预计会发生自连接。可以在连接反应中引入阴性对照反应,用于控制自身连接。加入反应中除插入DNA以外的所有成分。我们期望从对照反应中观察不到或非常少的菌落。从“实验”平板上挑取的菌落数取决于在对照平板上生长的菌落数。
4、在我们的实验中使用的miRNA模拟物的阴性对照是来自秀丽隐杆线虫的miRNA(cel-miR-67:ucacaaccucuagaaagaguaga)。尽管Thermo scientific-Dharmacon建议这种miRNA与人、小鼠和大鼠中已知的miRNA具有最小的序列同一性,但重要的是证实在我们感兴趣的mRNA片段中没有这种miRNA的潜在靶向位点。如果需要额外的阴性对照miRNA模拟物,可从Thermo scientific-Dharmacon获得替代对照(cel-miR-239b,UUGUACUACACAAAAGUACUG)。
5、虽然大多数研究都集中在位于3′-UTR的miRNA靶向位点,但在编码区也发现了许多miRNA靶向位点(在5′-UTR也有少量)。尽管我们在此提出的方法是用于检测位于靶mRNA 3′-UTR的miRNA靶位点,但它也适用于检测编码区的miRNA靶位点。这可以通过简单地将miRNA靶向序列插入pgl 3-控制载体的3′-UTR的XbaI位点来实现。这种方法已经在许多研究中使用
Methods Mol Biol. Author manuscript; available in PMC 2013 May 7.
Published in final edited form as:
Methods Mol Biol. 2013; 936: 117–127.
doi: 10.1007/978-1-62703-083-0_10