023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


CRISPR/Cas13系统是操作RNA的可编程工具,用于各种RNA靶向应用。在Cas13家族中,Cas13d是哺乳动物细胞中最活跃的亚型。最近,Cas13d被用作针对不同人类RNA病毒的抗病毒药物。然而,Cas13d在哺乳动物细胞的胞质溶胶中几乎没有活性,将其活性限制在细胞核中,这限制了可编程抗病毒药物的应用。大多数RNA病毒只在胞质溶胶中复制,这表明目前基于Cas13d的抗病毒药物依赖于不受控制的核漏出,因此其效率有限。
在这里,我们表明Cas13d crRNAs的核定位是Cas13d核偏好的根本原因。为了解决这一限制,我们设计了核质穿梭Cas13d (Cas13d-NCS)。Cas13d-NCS将核crRNA转移到胞质溶胶,在那里蛋白质/crRNA复合物结合并降解互补的靶RNA。我们筛选了穿梭蛋白质的各种设计,并表征了最佳表现系统的多个设计参数。我们表明,Cas13d-NCS在降解mRNA和来自委内瑞拉马脑炎(VEE) RNA病毒的自我复制RNA方面更优越。最终,我们利用Cas13d-NCS完全阻断了各种新型冠状病毒菌株的复制。因此,Cas13d-NCS使得CRISPR系统的亚细胞定位的合理操作成为可能。
为了通过常规Cas13d-NLS靶向哺乳动物细胞中的RNA,通过RNA聚合酶II (pol II)转录Cas13d mRNA,并将其翻译成蛋白。随后,根据核定位序列(NLS)将Cas13d蛋白导入细胞核,在此与RNA聚合酶III转录的crRNA形成复合物。蛋白质/crRNA复合物然后降解细胞核中的互补靶RNA(图1a)。最初,我们证实了先前的报道,即Cas13d融合到NLS (Cas13d-NLS包括三个C末端NLS基序;对应于图1f中的v1)与融合到核输出序列(NES;Cas13d-NES具有一个C-末端NES基序;对应于图1f)中的v5,并证实两种蛋白质变体都被正确定位(补充图S1)。由于mRNA在转录后迅速输出到胞质溶胶,常规的Cas13d-NLS具有非常短的时间窗来识别和结合其在细胞核中的靶mRNA。因此,我们推测Cas13d对核定位和活性的偏好可能是由crRNA的细胞核限制可用性引起的,从而将组装的复合物从胞质溶胶中排除。crRNA的染色显示它确实只存在于细胞核中(图1b)。这一发现表明,设计一个将crRNAs运输到胞质溶胶的系统可以改变Cas13d的定位偏好,这将使需要亚细胞精度的RNA靶向的应用成为可能。
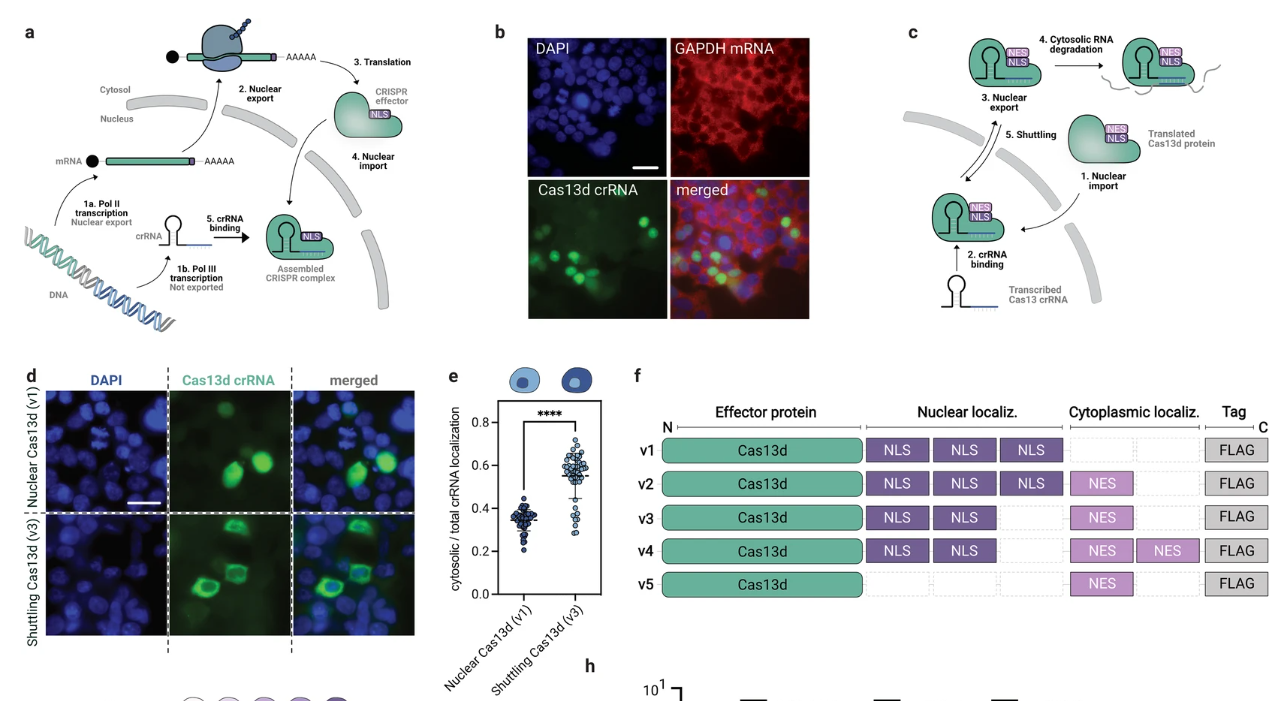
为此,我们探索了各种crRNA核运出策略。由于crRNA输出不足或敲除效率降低,核RNA输出基序8或聚合酶II启动子表达失败(补充图S2)。许多自然系统通过核质穿梭蛋白运送货物穿过核膜。因此,我们探索了核质穿梭Cas13d蛋白将crRNAs转运出细胞核的可能性。这种与NLS和NES基序的序列融合的穿梭Cas13d可以被输入到细胞核中,与crRNA结合,并再次输出到与结合的crRNA复合的胞质中(图1c)。与crRNA一起,我们表达了在C-末端与两个NLS和一个NES基序融合的Cas13d(图1f中的v3 ),并发现该系统确实能够将crRNA转运到胞质溶胶中(图1d,e)。接下来,如图1f中的示意图所示,我们产生了具有不同NLS和NES元素数值比的Cas13d变体。这些变体的亚细胞蛋白质定位的表征揭示了穿梭变体半定位于细胞核和胞质溶胶之间(图1g和补充图S3)。我们测试了这些变体切割共转染的荧光素酶转录物的效率,并发现所有穿梭的Cas13d变体与常规核Cas13d相比提高了敲除效率。由两个NLS和一个NES组成的最佳构型v3将报道基因表达降低了高达99.3%,是Cas13d-NLS的8.5倍(图1h)。该变体(v3)随后被命名为Cas13d-NCS。我们假设Cas13d-NCS最佳地平衡了足够的核输入以结合crRNAs和足够的核输出以有效地靶向主要定位于细胞质的mRNA。此外,我们发现,当在单独的细胞区室中表达时,Cas13d蛋白和crRNA显著减少,这表明对组分的稳定性有影响。
我们假设Cas13d-NCS在降解病毒胞质RNA方面也优于传统的核Cas13d-NLS,因为大多数RNA病毒只在细胞质中转录它们的mrna和基因组RNA 6。为了测试这一点,我们向来源于VEE病毒的胞质、自我复制的RNA中添加了一个mGreenLantern报告基因(图1i)。我们体外转录复制子RNA,转染细胞,选择和培养它们。随后,我们通过荧光显微镜证实了稳定的复制子表达,并且通过RT-PCR证实了仅基于RNA的复制,而没有DNA中间体(图1j和补充图S5a)。我们设计了9个crRNAs,靶向复制子RNA的不同区域,并通过流式细胞术比较了常规Cas13d-NLS (v1)与穿梭Cas13d-NCS的敲除效率(补充图S8)。值得注意的是,Cas13d-NCS的敲除很强,但Cas13d-NLS的敲除很弱,这证实了Cas13d-NCS与目前的Cas13d系统相比,以更高的效率仅靶向胞质RNA。
Cas13d-NCS克服了先前描述的基于Cas13d的可编程病毒7的次优定位的限制。为了评估Cas13d-NCS抗病毒疗效,我们将新型冠状病毒作为一个临床相关的例子。由于新型冠状病毒通过不连续的RNA合成机制表达亚基因组mRNA,所有病毒mrna都含有基因组3’非翻译区(UTR)11。我们用单个crRNA靶向该3’UTR,以直接降解所有病毒基因组和转录RNA(图1l)。为了证明Cas13d-NCS抗病毒药物的治疗潜力,我们开发并测试了一种基于RNA的表达系统,该系统由优化的Cas13d-NCS mRNA支架、化学稳定的crRNA组成,并将这两种成分配制成脂质-RNA复合物(补充图S6a,b)。首先,我们通过敲除96%的新型冠状病毒报道RNA,证实了表达Cas13d-NCS的RNA是有功能的(补充图S6c)。为了验证Cas13d-NCS的靶向准确性,我们分析了五个最有可能脱靶的基因的表达水平。用Cas13d-NCS和新型冠状病毒3’UTR crRNA或非靶对照crRNA处理的细胞中的水平没有显示出显著差异(补充图S6d)。接下来,我们将Cas13d-NCS mRNA和不同的crRNAs一起递送到细胞中,用新型冠状病毒-GFP12感染它们,并测量GFP表达作为随时间推移的病毒载量的量度。有趣的是,靶向保守但弱表达的病毒编码序列导致相对弱的抑制作用,而用单个crRNA靶向普遍存在的3’UTR导致完全抑制病毒复制(补充图S7a,b)。此外,追踪感染进展48小时的实时荧光显微镜显示,Cas13d-NCS完全阻止了新型冠状病毒-GFP报道病毒的复制(图1m)。此外,我们证实了cas 13d-NCS/3’UTR crRNA在病毒感染前24小时(图1n和补充图S7c)以及病毒感染后3、6和9小时(补充图S7d)施用时,有效地抑制了严重新型冠状病毒-δ变体的所有病毒转录物的复制和表达。Cas13d-NCS的灵活性和高效性证明了其作为针对胞质RNA病毒的程序化治疗的巨大潜力。
在我们的研究中,我们证明了由于crRNA的定位,传统的Cas13d应用仅限于细胞核。相比之下,Cas13d-NCS通过穿梭于细胞核和胞质溶胶之间将crRNAs转运出细胞核。先前通过融合NES将Cas13d系统重定向至胞质溶胶的尝试没有考虑crRNA定位或依赖于crRNA/蛋白质复合物的不受控制的核泄漏4,5,7。其他依赖于核转录gRNAs的CRISPR系统也可以通过将类似的工程原理应用于这些系统而受益于所描述的crRNA转运框架。总之,我们预计Cas13d-NCS将释放亚细胞精度RNA靶向的全部潜力,并使RNA相关疾病的新型分子工具和疗法的开发成为可能。