023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


Full article: Programmable RNA targeting with CRISPR-Cas13
RNA靶向CRISPR-Cas13系统实现了内源RNA的精确工程,大大推进了我们对RNA调控的理解和基于RNA的诊断和治疗应用的开发。本文旨在总结基于Cas13的RNA靶向工具及其应用,讨论现有工具的局限性和挑战,并为RNA靶向系统的进一步发展提出潜在的方向。
作为可编程核糖核酸酶的CRISPR-Cas13
成簇的规则间隔的短回文重复序列(CRISPR)和CRISPR相关蛋白(Cas)是细菌适应性免疫系统,其中大多数是有效的DNA/RNA核酸内切酶。在class 2 type VI CRISPR/Cas系统中,单亚基Cas13系统作为RNA引导的RNA内切酶(RNase)自2016年以来已有报道。Cas13a(也称为C2c2)是Cas13家族的第一个亚型。Cas13家族现在包含11个亚型,包括Cas13a [Citation1,Citation2],Cas13b [Citation3],Cas13c [Citation4],Cas13d [Citation4],Cas13e [Citation5],Cas13f [Citation5],Cas13g [Citation5],Cas13h [Citation5],Cas13i [Citation5],Cas13x [Citation6]和Cas13y [Citation6],可能还有更多有待鉴定。虽然这些Cas13系统都是RNA指导的RNA酶,但它们在大小、蛋白质序列和在真核细胞中的效率方面有所不同[Citation5,Citation6]。其中,Cas13a、Cas13b和Cas13d在哺乳动物细胞中应用最为广泛。
Cas13由CRISPR RNA (crRNA)引导,并被编程为切割携带互补原间隔区的RNA靶[Citation1](图1)。与大多数需要原间隔区相邻基序(PAM)的DNA靶向CRISPR/Cas系统不同,Cas13在真核细胞中对原间隔区侧翼序列(PFS)没有强烈的偏好,允许它靶向基本上任何序列。Cas13蛋白通常包含两个较高的真核生物和原核生物核苷酸结合(HEPN) RNase结构域,它们形成了切割靶RNAs的单一催化位点[引用7–10]。Cas13还具有另一种RNA酶活性,可以从由间隔区和直接重复(DRs)的多重重复组成的前crRNA阵列中加工其自身的crRNA[citation 2]。前crRNA加工活性通过从单个转录物表达多个crRNA(也称为指导RNA或gRNAs)来促进多重靶向[Citation11]。
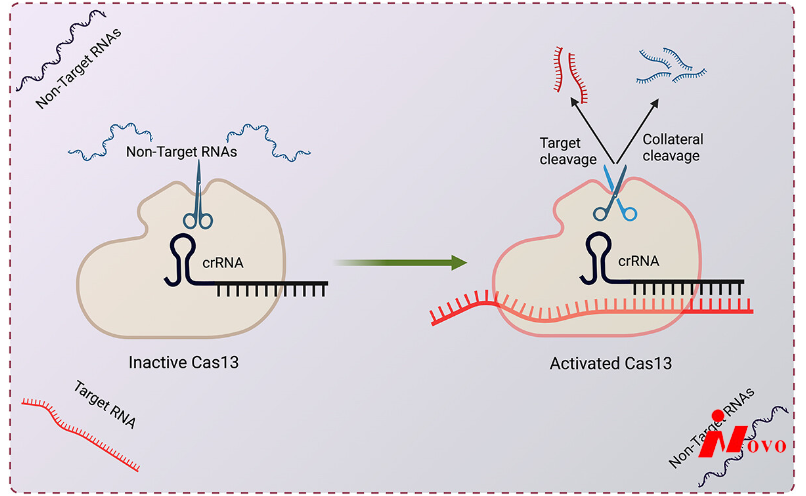
对哺乳动物细胞和植物细胞中Cas13的初步研究表明,其敲除水平与RNA干扰(RNAi)相当,并且特异性提高[Citation12]。虽然RNAi对核RNA的作用较弱,但Cas13能有效抑制核和细胞质RNA。例如,Cas13a已被用于敲除核非编码RNA,如MALAT1,HOTTIP[Citation11]和增强子RNA[citation 13]。Cas13a还被用于抑制癌症相关的融合转录物,例如EML4-ALK融合转录物,以抑制肺癌细胞中的细胞活力[Citation14]。除了线性RNA,Cas13d还可以通过使用导向RNA下调环状RNA(circrna),导向RNA靶向跨越circrna的反向剪接结合位点的序列[Citation15]。在没有PAM/PFS限制的情况下靶向基本上任何序列的灵活性允许大多数circRNAs被靶向而不影响线性转录物。除了内源性细胞RNA,Cas13还被用于降解病毒RNA,包括新型冠状病毒[Citation16],流感病毒[Citation16],艾滋病毒[Citation17],PRRSV [Citation18]和人乳头瘤病毒。
Cas13还被广泛用于体内,允许在异种移植肿瘤[Citation20,Citation21]和各种组织中靶向RNA敲除,包括眼[Citation22–24],耳[Citation25,Citation26],脑[citation 22,Citation27,Citation28],肺[citation 29–31],肾[Citation30],肝[Citation30]和脾[Citation30]。Cas13蛋白,尤其是Cas13d蛋白,明显小于Cas9,允许与gRNA表达盒一起有效包装到腺相关病毒(AAVs)中用于体内递送[Citation11]。AAV介导的针对几种癌基因的Cas13a/gRNA表达显著抑制了异种移植模型中的肿瘤生长[Citation20]。类似地,靶向致癌KRASG12D mRNA的AAV-Cas13d显著抑制小鼠患者来源的异种移植物中的肿瘤生长[Citation21]。除了肿瘤,AAV-Cas13d还被递送到特定组织,以分别在年龄相关性黄斑变性[Citation23]、听力损失[Citation25]、帕金森病[Citation22]、TDP-43蛋白病[Citation32]和肌萎缩性侧索硬化(ALS) [Citation33]的小鼠模型中敲除各种靶标并实现表型拯救。除了AAV,包括脂质纳米粒(LNPs) [Citation31]、细胞外泡囊(EVs) [Citation30]和基于雾化器的纳米配方RNA复合物递送[Citation29]在内的非病毒方法也已用于递送Cas13/gRNA,尤其是递送至肺部。
用CRISPR-dCas13编辑RNA
两个HEPN RNA酶结构域中的点突变使gRNA依赖的靶切割活性失活,允许靶RNA被结合而不被降解(图2)。虽然经常被称为催化活性缺失的Cas13 (dCas13),但所得的HEPN缺陷型Cas13保留了前crRNA加工RNA酶活性,因此保持了多重化能力。dCas13可以作为一种可编程的RNA结合蛋白(RBP),使其能够在特定转录物上作为内源性RBPs的竞争性抑制剂[Citation34]。类似地,其他功能性RNA信号如剪接位点、聚腺苷酸化信号和特定转录物的起始密码子可以被dCas13靶向,以分别调节剪接[Citation11]、聚腺苷酸化[Citation35]和翻译起始[Citation36]。
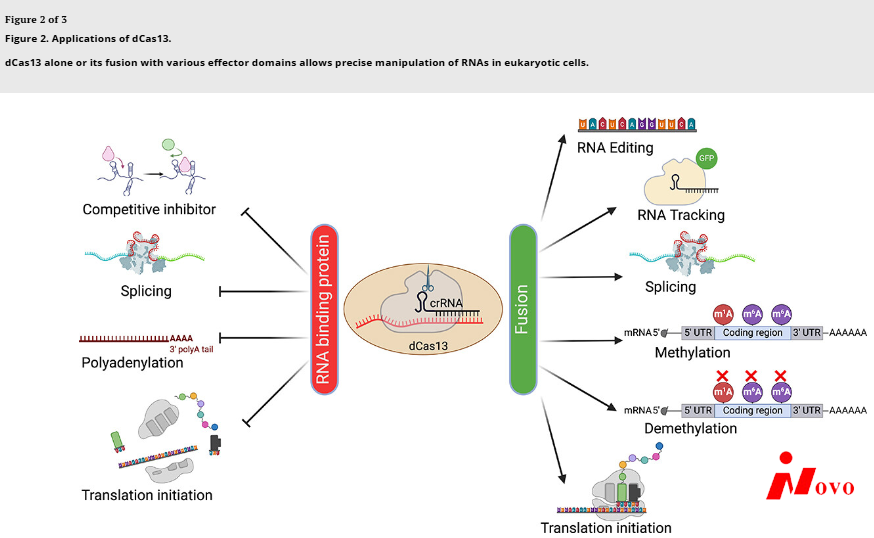
除了将蛋白效应器结构域融合到dCas13,通过将功能性RNA元件融合到gRNA可以产生新的功能。虽然类似的想法已成功用于基于dCas9的应用[Citation49,Citation50],但通过g RNA束缚RNA调控元件可能特别适合RNA靶向应用。例如,SINEB2 RNA元件已经与gRNA融合,以增强靶mrna的翻译[Citation51]。鉴于大量的功能性RNA调控元件控制着RNA生命周期的每一步[Citation52],我们设想通过将其他RNA元件与gRNA结合来进一步扩展dCas13 RNA toolkit。与蛋白质效应结构域相比,RNA元件通常小得多,这使得其更容易在腺相关病毒(AAV)中多重化和包装以用于体内递送。
Cas13的靶特异性:脱靶和错配耐受性
一般来说,CRISPR/Cas13对靶RNA之间的单个错配表现出耐受性,gRNA间隔区核苷酸15–21对靶位点的错配更敏感[Citation53]。超过两个错配的存在经常导致切割效率的降低[引用54],尽管在某些情况下可以容忍更多的错配[引用55]。此外,对错配的敏感性在RNA靶RNA双链体中的位置以及错配的核苷酸同一性上也是高度可变的[引文56,引文57]。缺乏一套简单的靶向特异性规则,需要使用每个Cas13系统的错配容差的大规模实验测量来训练复杂的机器学习模型。令人鼓舞的是,至少有两种方法被证明可以降低错配耐受性,并允许特异性检测SNPs。第一种方法是合成错配,即使用与所需靶有一个或多个错配的gRNAs。Cas13将容许目标中有限数量的错配,但不会容许在非目标中发现更多错配。第二种方法是在gRNA的3’末端用一段序列延伸间隔区,该序列将与间隔区形成一个短茎环/发夹。通过阻断部分间隔区,发夹阻止了gRNA与非靶RNA序列的结合,并提高了CRISPR/Cas13a系统用于单核苷酸多态性(SNP)鉴定的特异性[Citation60]。尽管进行了广泛的研究,增强Cas13系统的特异性仍然是一个值得进一步关注和改进的领域。
Cas13在细菌和体外的侧枝活性
在靶RNA识别后,Cas13经历构象变化并成为活化的RNase。与大多数在导向/靶双链内切割的Cas蛋白不同,激活的RNase位点暴露在Cas13的表面[Citation7,Citation8],使其不仅可以切割顺式结合的靶RNA,还可以切割反式的其他邻近RNA(图1)。这种间接活性允许细菌在噬菌体感染时降解噬菌体RNA和宿主RNA,导致宿主细胞的生长停滞和感染周期的流产[Citation61]。类似的“自杀”反应也由其他几种抗病毒系统触发[Citation62],包括IIIA CRISPR-Cas型系统,该系统采用RNA酶Csm6,不加区分地降解病毒和宿主RNA。
重要的是要记住,附带活动从根本上不同于传统的脱靶效应。CRISPR或RNAi的非靶仍然直接与指导RNA或siRNA配对,尽管有一个或多个错配。相比之下,Cas13侧枝活性是无差别的,并且降解的底物不需要与指导RNA具有序列互补性。此外,脱靶效应在很大程度上不依赖于预期的on-target是否存在,而侧枝活性仅在识别与指导RNA完全匹配的on-target RNA时被激活,尽管原则上常规的脱靶也能激活侧枝活性,只要错配是容许的。
Cas13的并行活动在许多领域都有不同的应用(图3)。例如,感知特定序列和诱导细菌细胞自毁的能力已经用于序列特异性细菌杀灭。通过将编程的CRISPR-Cas13a识别耐药基因包装到噬菌体衣壳中,Kiga和他的同事们创造了一种新型抗菌剂,称为“CapsidCas13a(s)”,它抑制了耐碳青霉烯大肠杆菌和耐甲氧西林金黄色葡萄球菌的生长,这两种细菌以对常见抗生素的耐药性而闻名[Citation63]。支持Cas13侧枝活性在导致观察到的生长停滞中的作用,用CRISPR/Cas9靶向相同的基因没有导致相同的缺陷,这是未知的具有侧枝活性。
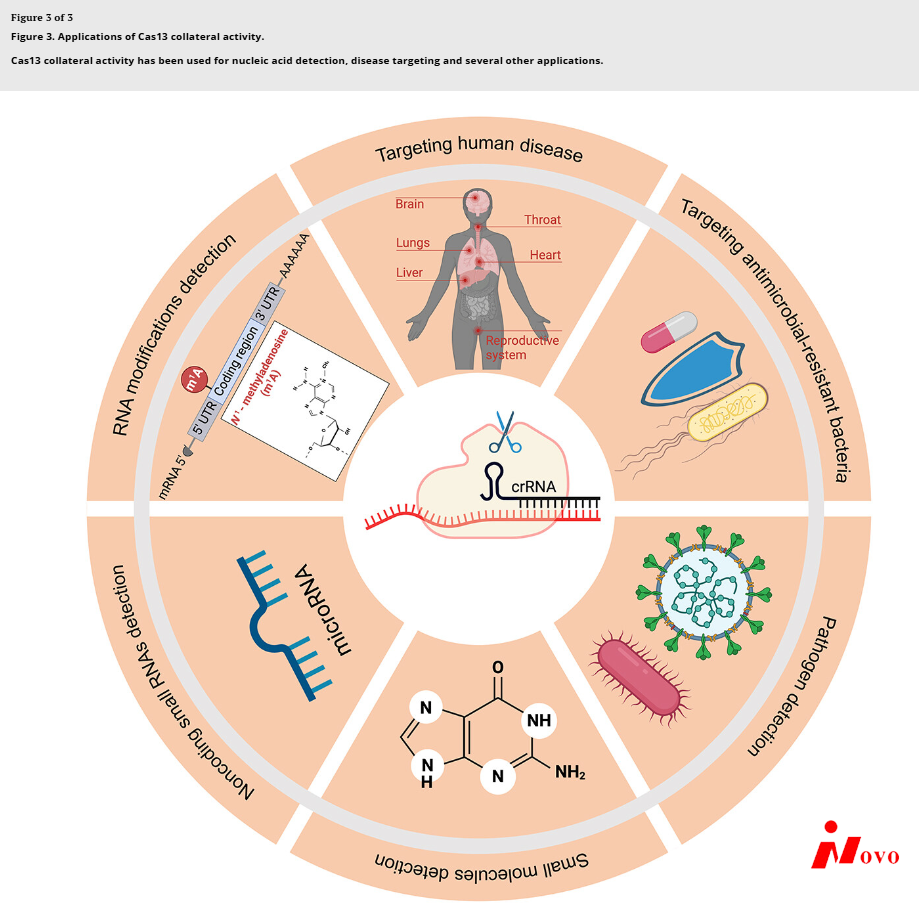
Cas13侧枝活性也被用于RNA或DNA的灵敏检测(当与体外转录结合时)。在靶RNA存在的情况下,活化的Cas13a切割自猝灭的报道RNA,导致荧光发射。发射的荧光量与目标RNA的浓度成正比。通过目标的等温扩增和加入Csm6(一种辅助的CRISPR相关酶)可以进一步提高灵敏度[Citation64]。由此产生的夏洛克平台允许对致病病毒(如寨卡病毒和登革热病毒)和细菌进行超灵敏检测,并且在区分特定病毒株、人类单核苷酸多态性和肿瘤突变方面也具有高度特异性[Citation58]。包括HUDSON [Citation65]、SHINE [Citation66]、CASCADE [Citation67]、RT-LAMP-CRISPR-cas 13a[citation 68]在内的几个相关平台的技术改进已经允许快速、免仪器和免提取地检测来自未提取样品的RNA,包括新型冠状病毒RNA。CARMEN-Cas13与CARMEN平台集成,可在单个阵列中同时分析超过4,500个crRNA-靶标对,可在一次测试中检测到所有169种与人类相关的病毒[Citation69]。Cas13还被用于检测微小RNA[citation 70,Citation71],RNA修饰[Citation72],以及与核糖开关偶联的小分子[Citation73]。
真核细胞中的Cas13侧枝活性
虽然支持Cas13在体外和细菌系统中的侧枝活性的证据是丰富而明确的,但在真核细胞中这种活性的程度仍然是各种已发表论文中不一致的主题。对Cas13a和Cas13d的早期研究没有报告哺乳动物细胞中的任何脱靶或副作用[Citation11,Citation12,Citation42]。相反,这些研究表明,当用RNA-seq分析时,Cas13介导的转录物敲除具有显著的特异性,与数百个shRNA介导的敲除相比,没有脱靶。在果蝇转基因细胞系Sg4_CD中,许多Cas13变体可以有效地敲除eCFP报道基因,而不影响共表达的DsRed报道基因[Citation74]。另一项研究在斑马鱼胚胎中测试了Cas13d介导的转录敲除,并未观察到毒性效应、脱靶影响或间接活性[Citation75]。类似地,Cas13a下调人肺上皮细胞A549的内源性PPIB和KRAS mrna,而11个管家基因和18S rRNA的表达没有显著变化[Citation29]。
然而,最近的研究使用多种分析方法在哺乳动物和果蝇细胞中发现了各种Cas13系统的大量间接活性[Citation6,citation 76–79]。例如,我们和其他人已经表明,如通过qRT-PCR、Northern印迹、Western印迹和荧光成像所测量的,靶向报道基因mrna(例如EGFP)或内源RNA(例如ACTG1)可以导致共表达的非靶向报道基因RNA(例如mCherry)、Cas13 mRNAs和其他内源RNA的降解。多项研究也报告了RNA完整性的丧失,如变性RNA凝胶或生物分析仪运行中rRNA切割和断裂所示[Citation78]。我们进一步表明,从Cas13靶细胞中提取的总RNA减少了46%,这支持了由Cas13侧枝活性引起的总RNA降解[Citation77]。此外,使用polyA+ RNA-seq和外部尖峰信号,我们已经表明几乎整个转录组都被Cas13侧链活性下调,包括GAPDH、ACTB和其他看家基因[Citation77]。
我们如何调和关于真核细胞中Cas13侧枝活性的矛盾观察?在一些研究中,基于内部对照的标准化的困难可能导致无法检测到侧枝活动,因为常用的对照如GAPDH甚至rRNA也受到Cas13侧枝活动的下调[引文77]。此外,最近的研究表明,侧枝活性的程度与靶RNA丰度密切相关[引用76,引用77,引用79],早期报告缺乏侧枝活性的研究主要针对低丰度RNA[引用11]。对于不同亚型的Cas13蛋白,观察到的侧枝活性也有很大差异,其中Cas13d表现出最强的作用,其次是Cas13a,然后是Cas13b [Citation79]。有趣的是,侧枝活动的程度也因细胞类型而异。例如,已表明Cas13a在U87细胞中表现出更强的侧枝活性,但在HEK293T细胞中没有[Citation78],尽管我们使用Cas13d在HEK293T细胞中观察到非常强的侧枝活性[Citation77]。这种实质性的变化可能是由于这些细胞中Cas13、gRNA和靶RNA表达水平的变化,甚至是细胞pH的变化[citation 80–84],因为RNase活性对pH敏感[Citation85]。因此,观察到的侧枝活动的程度取决于多种因素,这可能是文献中报道的矛盾结果的潜在原因。
使用Cas13敲除细胞中的特定靶RNA,尤其是大量靶RNA时,细胞RNA的非故意无差别降解是一个主要问题。虽然减少Cas13/gRNA丰度[Citation86]或稳定性[Citation76]可能会减少脱靶结合,从而减少脱靶激活的侧枝活性,但在不损害脱靶敲除效率的情况下减少脱靶激活的侧枝活性本身就具有挑战性,因为相同的活性位点负责两种活性。尽管如此,Cas13亚型(例如PspCas13b vs RfxCas13d)之间的侧枝活性差异显著,并且最近已经鉴定出具有最小细胞毒性的新型Cas13直向同源物(例如DJ cas 13d)[citation 87]。此外,Cas13d和Cas13X的高保真变体也已被改造[Citation88],特别是RfxCas13d-N2V7变体已独立显示出比cas 7–11更具特异性,cas 7–11是另一种未知具有并行活性的RNA靶向CRISPR系统[Citation32,Citation89]。这些Cas13变异体/直向同源体是如何调节侧枝活动的,其机制尚不清楚。可能性包括结构变化,使活性位点更靠近靶区域,更少暴露在表面上,或降低活性cas 13-gRNA-靶三元复合物的稳定性,使其保持足够长的活性以切割非常接近的靶RNA,但不足以切割细胞中大量的其他RNA。
用CRISPR-Cas13进行序列特异性细胞靶向
Cas13侧枝活性的激活阻止了受感染细菌的生长。类似地,在人类细胞中,Cas13介导的报告mRNA或非必需内源性mRNA的靶向作用显著降低了细胞的生存力和增殖[Citation77]。类似于侧枝RNA降解,生长缺陷的程度与靶RNA丰度正相关[Citation77]。虽然在一些研究中观察到细胞凋亡[Citation76],但其他研究报告称细胞死亡没有增加,只是细胞代谢活性和DNA复制减少[Citation77]。有趣的是,类似于RNA酶对细胞核的处理[Citation90,Citation91],Cas13的并行活性也导致染色质的崩溃,潜在地有助于整体mRNA的下调和DNA复制的抑制。在体内也观察到了Cas13侧枝活性的毒性。引人注目的是,Cas13d介导的成年小鼠大脑中几种非必需mRNAs的敲除导致了动物死亡[Citation92]。致死性严格取决于Cas13、gRNA和靶的同时表达,表明毒性是由间接活性而不是脱靶效应驱动的[Citation92]。
通过感知标记RNA来抑制细胞生长甚至诱导细胞死亡的能力为序列特异性细胞靶向打开了大门。诸如癌细胞、活化的成纤维细胞和衰老细胞的致病细胞的可编程消除将分别促进对抗癌症、纤维化和衰老的疗法的发展。这种技术平台还将允许对单细胞RNA测序未发现的新细胞类型或细胞状态进行功能研究。作为原理证明,我们之前在竞争生长试验中证明了一个细胞亚群可以通过Cas13介导的对靶细胞群体中唯一表达的可分配报告RNA的感知而被选择性去除[Citation77]。通过靶向癌症特异性致癌mRNAs,相同的概念已经应用于体内选择性消除癌细胞。例如,Kang和他的同事表明,Cas13a靶向致癌EGFRvIII mRNA显著抑制体内肿瘤生长[Citation78](尽管仍需证明Cas13的间接活性,而不是致癌靶mRNA的单独丢失,驱动肿瘤消退)。进一步增强Cas13的侧枝活性将能够更有效地杀死细胞。令人鼓舞的是,Yang和他的同事已经证明,通过将一个额外的RNA结合结构域插入到其HEPN结构域内独特的活性位点近端环中,可以增强Cas13a的侧枝活性[引文93]。
未解决的问题
鉴于Cas13系统在生物医学研究、临床诊断和潜在治疗应用中的众多应用,了解其局限性并避免潜在缺陷至关重要。虽然Cas13的高保真变体减轻了对靶向RNA敲除的非预期侧枝RNA降解的担忧,但最近的研究发现了单独表达Cas13或gRNA的意外效果。对这些观察结果和潜在机制的深入理解将有助于为各种应用开发下一代高保真Cas13工具。
指导RNA的Cas13独立效应。虽然gRNA被认为首先装载到Cas13中,然后通过序列互补结合靶RNA,但gRNAs靶双链体很长(20-30bp ),即使在没有Cas13的情况下也能在细胞中稳定形成。仅通过gRNA的结合可能阻断靶mRNA上的调节位点或募集双链RNA (dsRNA)结合蛋白。例如,当在植物中使用时,具有28-nt而不是20-nt间隔区的Cas13 gRNAs在缺乏Cas13a的情况下通过内源RNAi机制下调靶RNAs[citation 94]。在具有28-nt间隔区的Cas9 gRNAs中也观察到这种效应。在人类A459细胞中也进行了类似的观察:在缺乏Cas13a [Citation29]的情况下,三分之一的测试grna降低CXCR4 mRNA超过90%,尽管在这种情况下不清楚是否使用了长间隔区以及是否涉及RNAi机制。类似地,在缺乏Cas13b蛋白的情况下,表达具有31-nt间隔区的Cas13b gRNAs降解了蚊子细胞中的病毒RNA[citation 95]。这种不依赖Cas13的RNAi样靶沉默可能会导致靶向敲除的更多脱靶效应,并使基于dCas13的应用(如成像和剪接调节)的解释变得复杂。还表明,当间隔区长于40-nt时,与靶RNA形成的长双链体将通过募集内源RNA编辑酶ADAR1而触发有效的靶RNA编辑[Citation96]。编辑后的靶RNA可能不再触发Cas13介导的切割,这可能解释了为什么长于30-nt的gRNAs导致较低效率的敲除[引文53]。这些不依赖于Cas13的grna效应强调了使用带有长间隔区的Cas13 gRNAs的注意事项,并强调了正确控制的重要性。对于广泛使用的Cas13直向同源物和高保真变体,需要更系统的研究来了解Cas13非依赖性效应的普遍性以及如何避免它。
指导RNA非依赖性Cas13活性和毒性。几项研究报道了当Cas13的某些变体在没有相应gRNAs的情况下单独表达时意外的毒性。例如,LwaCas13a或PspCas13b的基于质粒的表达,而不是RfxCas13d (CasRx)单独抑制小鼠神经元原代培养物中的神经突和树突生长[Citation97,Citation98]。类似地,注射PguCas13b和PspCas13b而不是RfxCas13d蛋白会损害斑马鱼胚胎发育[Citation75]。虽然RfxCas13d/CasRx在培养的小鼠神经元中毒性较低,但普遍表达的CasRx导致苍蝇胚胎死亡,因为不能产生CasRx的纯合子苍蝇[Citation99]。耐人寻味的是,即使是dCasRx纯合子苍蝇也无法生成。这一观察表明,观察到的毒性可能是由前crRNA加工RNA酶活性引起的,该活性在dCas13中保持完整[引用100,引用101]。Cas13/dCas13蛋白识别前crRNAs中的直接重复区,形成具有中等序列特异性的短发夹。类似的发夹结构可能在真核细胞的许多内源性RNA中发现,特别是在已知富含dsRNAs的神经元中[Citation102]。对这些直接重复样结构的识别将导致内源转录物的裂解和降解,潜在地引起细胞毒性。为了支持这一观点,李及其同事发现LwCas13a、PspCas13b和RfxCas13d都能结合HEK293T细胞中的数千种内源性mRNAs,并且能够在体外切割内源性RNA,而无需相应的gRNAs [Citation103]。未来的研究将描述Cas13/dCas13是否将内源性RNA加工成crRNA/grna,以及灭活前crRNA加工活性是否会消除gRNA非依赖性毒性。
结论
自2016年首次发现以来,RNA靶向CRISPR/Cas13系统不仅改变了RNA生物学的基础研究,还大大推进了基于RNA的诊断和治疗。以高效和特异的方式靶向RNA、细胞核或细胞质中基本上任何序列的能力,使Cas13成为基因靶向的有力工具。其紧凑的尺寸,加上其固有的灵活性,进一步增强了其作为治疗平台的潜力。不断扩展的dCas13工具包促进了具有单核苷酸精确度和特异性的各种RNA操作。在不改变DNA的情况下,精确编辑内源性RNA的能力,包括数千个碱基的替换或插入,为开发一系列疾病的更安全疗法打开了大门[Citation41]。Cas13的间接活性,虽然最初被认为是一种限制,但已被证明在病原体检测方面非常成功,并有可能成为精确细胞靶向的强大平台。我们预计Cas13技术将继续发展,在生物医学研究、基于RNA的诊断和RNA靶向治疗中实现更令人兴奋的应用。