023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


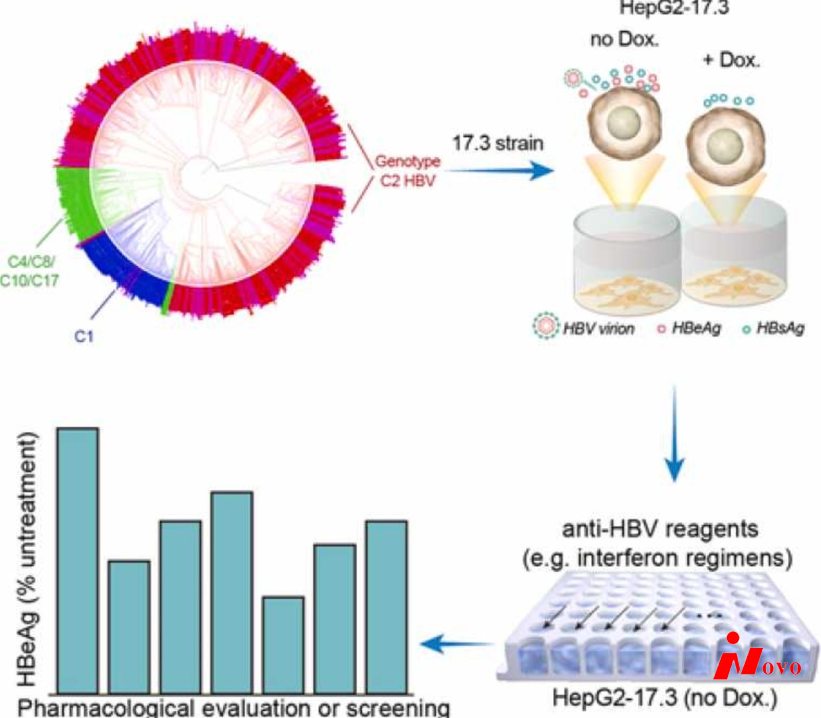
乙型肝炎病毒(HBV)基因型C与不良预后密切相关,是中国和世界范围内慢性乙型肝炎(CHB)相关肝病的主要原因。然而,对HBV基因型C的机制研究仍然很有限,部分是因为长期缺乏基于基因型C HBV的稳定细胞工具。根据对中国主要流行的C2 HBV亚型的生物信息学分析,我们选择17.3株作为代表性分离物。使用Tet-off基因表达系统,在携带持续rcDNA-cccDNA再循环的细胞系中实现了C2 HBV基因型的诱导型病毒复制和病毒体DNA生产,称为HepG2-17.3,可用于病毒学研究。此外,该细胞系已被形成为基于细胞的测定法,其允许对候选药物(如干扰素疗法)进行特定的药理学筛选,以评估对基因型C2 HBV复制的抑制作用。
乙型肝炎病毒(HBV)感染是一个严重的全球公共卫生问题,慢性乙型肝炎(CHB)患者有发展为肝硬化和肝细胞癌的高风险(HCC) [1],[2]。如今,2.57亿患者患有慢性HBV感染相关的肝病,其中超过三分之一的患者生活在中国[3]。HBV基因型与预后和治疗反应密切相关,而基因型C HBV在中国是地方性的,具有较高的HCC风险和较低的干扰素治疗反应率[4],[5]。因此,基因型C的HBV应该得到更多的关注[6]。
HBV基因组是一个松弛的环状部分双链DNA,覆盖3.2 kb [7]。基于全基因组序列内7.5%或更高的组间差异,HBV可被系统发育分类为9种基因型(A-I)和一种推定的基因型(J)。此外,这些基因型被细分为许多亚基因型,如A1-A2、B1-B6、C1-C17和D1-D6 [4],[8]。一般来说,HBV基因型A和C比基因型B和D具有更高的慢性化倾向[9],[10],而HBV基因型C是最具致癌性的[11],[12]。此外,感染基因型C HBV的患者会出现HBeAg/HBeAb血清转换延迟[13],对干扰素治疗的反应更差[14]和更严重的肝纤维化[12]。作为中国的一个主要基因型[5],基因型C HBV的较差临床结果可能在很大程度上导致了那里沉重的CHB负担。
特别是,与其他亚型相比,C2更容易引起慢性感染[15],具有更高的核苷类似物(NA)抗性突变(rtM204I,rtA181V)发生率[16],并在儿科患者中表现出更高程度的肝脏炎症、纤维化阶段和ALT水平[17]。作为一种预后较差的HBV亚型,C2在最近的文献中被特别关注和评估[18]。然而,与在稳定的HBV复制细胞系HepG2.2.15中测试的D1亚型不同,C2基因型的评估是在质粒瞬时转染的Huh7细胞中进行的,这不太方便且不可持续。
持久的HBV复制细胞系(例如HepG2.2.15)提供了进行抗HBV药理学评价的有用工具。可诱导的HBV复制细胞系,如HepAD38和HepDE19细胞,进一步提高了HBV复制效率,并使筛选大规模化合物的抗HBV活性成为可能[19],[20]。不幸的是,大多数已建立的HBV复制细胞系是基于基因型D(表1)建立的,这种基因型既不是与HCC相关的关键基因型,也不是在亚太地区流行的基因型。考虑到中国沉重的乙肝负担,我们分析了HBV基因型在中国的流行情况,证实C2基因型是主要的基因型。然而,目前还没有基于该亚基因型建立稳定的细胞模型[21]。利用基因型C2的代表性17.3菌株,我们构建了Tet-off诱导型复制细胞系HepG2-17.3,并评估了其对不同类型干扰素的反应。IFN-γ联合IFN-α抗病毒效果最好。此外,在HepG2-17.3中存在rcDNA-cccDNA再循环,这使得它有希望作为一种工具来筛选可能影响cccDNA积累的候选物。总的来说,我们的研究提供了一种新的诱导型HBV产生细胞系HepG2-17.3,它有可能应用于C2 HBV基因型以及相关的慢性乙型肝炎和肝癌的药理学研究。
基因型C2 HBV菌株更容易导致严重肝病[17],[46],这一显著的临床特征在基础或转化研究中日益得到认可[18],[47]。对于C2 HBV基因型的药理学研究,稳定诱导的病毒复制细胞工具是有价值的和迫切需要的。另一方面,中国拥有世界上最多的HBV患者(约7000万),要实现死亡率降低65%还有很大的差距