023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


本说明书适用于以下产品:
名称 | 货号 |
pLV-TRE-EGFP | CR3013 |
原理:
本系统通过慢病毒将转录激活蛋白TetOn及可调控TRE启动子控制的spCas9蛋白基因转入目的细胞。目的细胞稳定表达TetOn蛋白。在没有Dox(Doxycline)存在的情况下,TetOn蛋白不能与TRE启动子结合。加入Dox后,TetOn蛋白构象发生改变,结合到TRE启动子,启动spCas9蛋白表达。
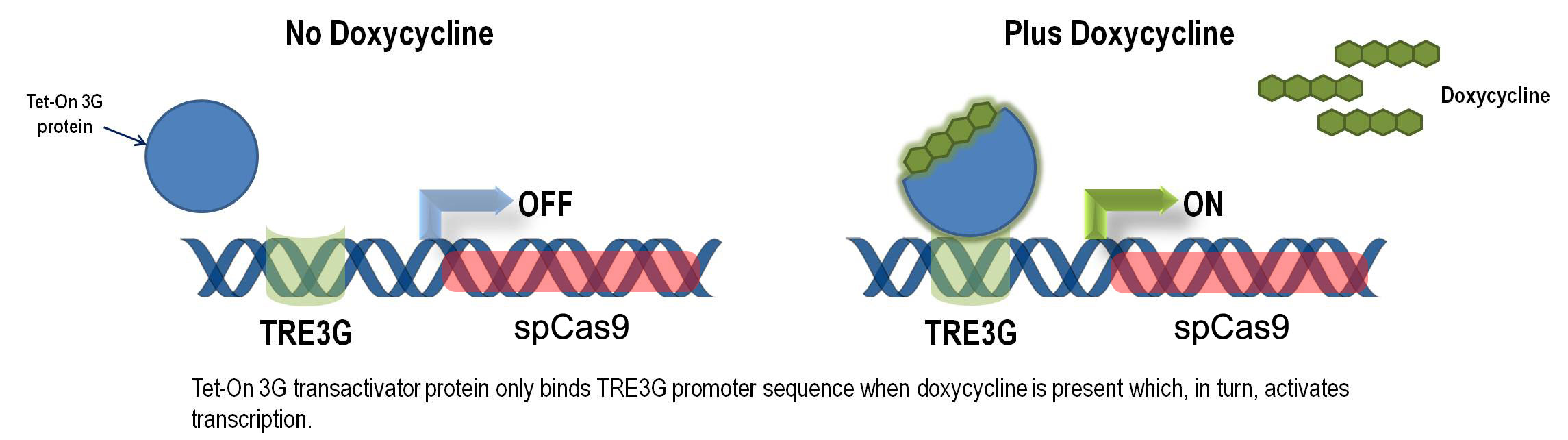
慢病毒可诱导Cas9表达系统组成:
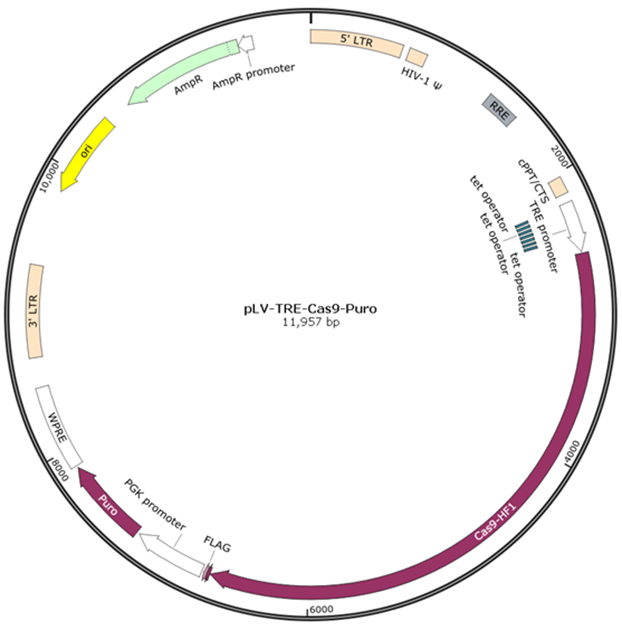
pLV-TRE-Cas9-Puro载体
在TRE启动子控制下表达spCas9-HF1蛋白。spCas9-HF1蛋白为spCas9的突变体,与野生型spCas9蛋白相比,spCas9-HF1蛋白能显著减少非特异性切割。spCas9-HF1蛋白有NLS核定位信号及Flag标签。
载体上有puromycin抗性基因,用于筛选稳定整合的细胞。
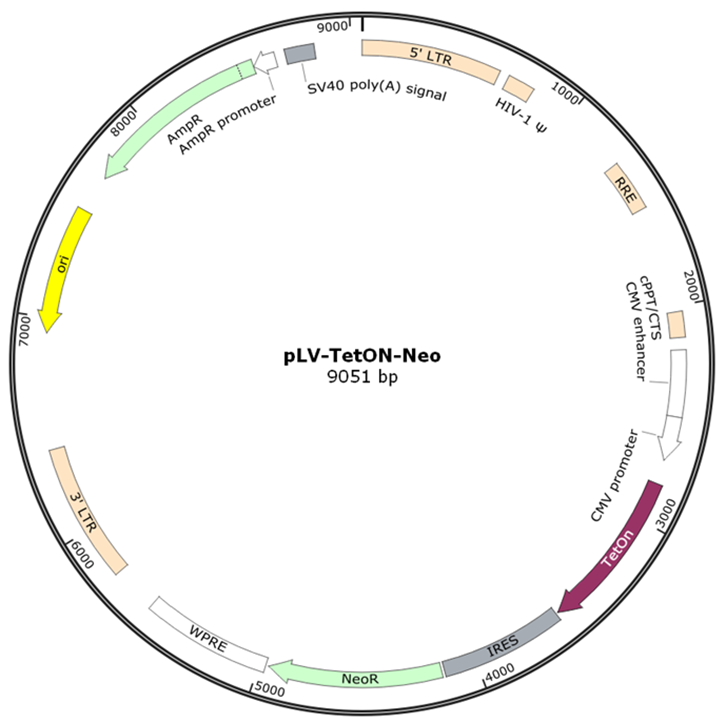
pLV-TetON-Neo载体
表达转录激活蛋白TetON及Neomycin抗性基因。
所需其他材料
pH1、pH2慢病毒包装载体(货号KLV3500)或者类似慢病毒包装载体。
293V或者293T慢病毒包装细胞。
G418、puromycin抗生素。
诱导剂Doxycline。
产品以小提质粒的形式提供,使用前需要转化大肠杆菌感受态细胞进行扩增。一般商业的感受态细胞均可使用。请按照感受态细胞生产厂家说明书进行操作。
在细胞转染前需要制备转染级无内毒素质粒。请选择可靠的试剂盒进行制备。
pLV-TRE-Cas9-Puro和pLV-TetON-Neo为第二代慢病毒载体。请选择相应的包装载体进行慢病毒包装。下面病毒包装步骤以我公司的pH1、pH2包装载体及Polyfect-C转染试剂为例。
本例中病毒包装采用10cm培养皿。如需用其它规格细胞培养器皿进行转染和病毒包装,请根据细胞相对生长面积对培养液体积和转染试剂用量进行相应调整。
试剂
293V培养基:DMEM高糖培养基+10%FBS
病毒培养基:DMEM高糖培养基+10%FBS,丙酮酸钠1mM。
Polyfect-C转染试剂
转染级慢病毒载体,包装载体pH1及pH2。
转染前24小时,将293V细胞以4-5x106/10cm平皿密度接种,加入10ml 293V培养基37℃,5% CO2培养。细胞转染前密度应达到90%。
漩涡震荡混匀Polyfect-C转染试剂。
准备2个离心管,按以下顺序分别制备质粒和转染试剂稀释液。
离心管1(质粒DNA) | 离心管2(转染试剂) |
慢病毒载体5ug | Polyfect-C转染试剂 20 ul |
pH1载体3.75ug | DMEM无血清培养基480ul |
pH2载体1.25ug | 总体积500ul |
DMEM无血清培养基 X ul |
|
总体积500ul |
|
充分混匀。
将转染试剂稀释液(离心管2)加入质粒DNA溶液(离心管1)中,立刻充分混匀。注意加入顺序非常重要。
室温孵育转染混合液15分钟。
将1ml转染混合液逐滴加入步骤1准备的细胞培养皿,前后晃动培养皿,充分混匀。
37℃培养。
4-6小时后,用10ml新鲜的293V培养基换液。转染后24小时,用10ml病毒培养基换液。
转染后48、72小时收集细胞培养上清。500g离心10min去除细胞碎片。该上清可以直接用于慢病毒感染,也可以进行病毒滴度测定或病毒浓缩。如需长时间保存,可-80℃冻存。切勿反复冻融。
PEG慢病毒纯化试剂纯化法
PEG慢病毒纯化试剂我公司研发的基于PEG6000沉淀法纯化慢病毒试剂,纯化过程中无需使用高速离心机进行长时间离心,全部纯化时间仅需2小时左右。PEG慢病毒纯化试剂可将病毒液浓度提高10-20倍,病毒回收率在95%以上。
操作步骤:
收集病毒上清液,室温500g离心10分钟,去除细胞碎片,将病毒液转移到一个新的离心管中。
用0.45um过滤器过滤病毒液。
将病毒液转移到新的离心管,保证病毒液体积不超过离心管容积的2/3。准确计量病毒液体积,每10ml病毒液加入PEG慢病毒纯化试剂4.7ml。
注意:PEG慢病毒纯化试剂比较粘稠,需要缓慢吸取,缓慢加入。保持病毒液和纯化试剂体的精确体积比非常重要。
反复颠倒混匀,直到病毒液和纯化试剂完全混合。4℃沉淀1.5小时,每0.5小时将混合液反复颠倒混匀1次。(可将病毒混合液放置在冰水混合物中,或者4℃冰箱进行沉淀)。
沉淀完成后病毒混合液应该变浑浊。4℃,7000g,10min离心病毒混合液。离心后可见白色沉淀。去除上清。
将离心管倒置在滤纸上,去除残留液体。用原病毒液体积1/20的PBS重悬沉淀。分装用-80℃冻存。
超速离心纯化法
用70%乙醇消毒SW28超速离心管,紫外照射30分钟灭菌。
将收集的病毒上清液32ml加入离心管。用移液管吸取4ml 20%蔗糖溶液,小心添加到液体底部。(注意将移液管头伸入离心管底部缓慢添加)。
用PBS调节每个管的重量,直到彼此相差不超过0.1g。
离心管放入Beckman SW28超离心机转子。
以4℃,25,000r.p.m(82,700g)离心2小时。
小心地从转子中取出离心管,倒出上清液,将管放在纸巾上,倒置10分钟。吸出残留液滴。
向沉淀物中加入100ul PBS。4℃孵育2小时。每20分钟漩涡震荡一次。
使用移液器,轻轻吹吸液体重悬。避免形成气泡。
储存在80℃。
同时转染:为了建立完整的Cas9诱导表达系统,细胞必须同时表达TRE3G-Cas9和TetON3G蛋白。同时转染TRE3G-Cas9和TetON3G病毒,并采用G418和嘌呤霉素同时筛选的方法可以很快获得两种基因共表达的细胞株。
病毒比例:一般来说,我们发现1:1的比值效果最好。您也可以进行实验测试不同的病毒比例,实现最佳的转染效果。
分别转染:如果您正在细胞系转染效率不高,我们建议您使用慢病毒进行顺序转导,以便提高成功率。首先用TetON3G慢病毒转导细胞,然后用G418进行筛选。(选做:进行单克隆筛选,选出TetON3G高表达的克隆,也可以进行Tet-On 3G诱导实验。例如,用pLV-TRE3G-EGFP转染克隆并选择展现诱导型荧光表达最好的克隆。)然后用TRE3G-Cas9慢病毒转导表达TetOn 3G的克隆。使用嘌呤霉素选择双转导的细胞。
筛选抗生素浓度确定方法:
在使用G418、潮霉素B或嘌呤霉素筛选稳定细胞系细胞之前,需要先通过梯度实验确定适合该类细胞的最佳药物浓度。对于一些常见的细胞系,通常可以在资料中找到推荐的药物浓度。例如Hela细胞用400ug/ml的G41或1ug/ml的嘌呤霉素进行稳定细胞株筛选。
用G418或潮霉素B,选用在5天左右出现细胞大批死亡,2周全部死亡的浓度作为筛选浓度。对于嘌呤霉素,通常采用在3-4天杀死全部细胞的浓度。不同批次的药物活性有一定差异。因此在使用新批次药物时,需要重新测定最佳浓度。
筛选抗生素的推荐使用浓度(ug/ml)
抗生素 | 工作范围 | 常用筛选浓度 | 常用维持用量 |
G418 | 50-800 | 400-500 | 100 |
Hygromycin | 50-800 | 200 | 100 |
Puromycin | 0.25-10 | 0.5-5 | 0.25 |
1、在加入筛选药物前一天将细胞以50%密度接种到6孔板。第二天在培养基中按G418(0,50,1000,200,400,800ug/ml)或者嘌呤霉素(0,1,2.5,5,7.5,10ug/ml)加入。
2、用G418筛选处理5-10天。每2天观察细胞一次。每4天更换新的有抗生素的培养基(如果有必要可以更换得更勤)。直到得到最佳浓度。选择7-10天细胞全部死亡的抗生素浓度为筛选浓度。
3、用嘌呤霉素处理4-7天。每2天更换新的有抗生素的培养基。选择3-4天细胞全部死亡的抗生素浓度为筛选浓度。
参考:慢病毒感染细胞的方法:
转染前12-18小时,接种细胞到合适的培养皿。
解冻您制备的慢病毒样品。
将polybrene加入到细胞培养物中,根据您细胞的特点,使用浓度为4-10ug/ml,多数细胞6ug/ml可以获得较理想的效果。
加入适量的慢病毒。病毒液体积不超过细胞培养液体积的20%。
24小时后换普通培养基培养。
转染后48-72小时加入抗生素进行筛选。
1-2周后,细胞不再死亡,收集细胞进行分析或者进行单克隆分选。
Dox的使用浓度为100-1000ng/ml。我们建议您采用TRE3G-EGFP对照基因做Dox浓度梯度诱导实验,以确定最佳诱导浓度。Dox在培养基中半衰期为24h,为持续表达,需要每48h补充Dox。
相关产品:
货号:CG018 HEK293V-tet可诱导EGFP细胞株