023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


通过将转录激活效应子与dCas9融合,或修饰gRNA成为支架并利用它招募转录激活效应子都可以实现对目的基因的激活调控。以下将比较使用这两种策略的不同激活系统并对其效率进行评价。
1 转录激活效应子与dCas9融合
研究表明,将单纯疱疹病毒蛋白VP16的TAD四聚体构成的VP64作为可以招募和稳定启动前复合物的转录因子与dCas9蛋白融合称为dCas9-VP64,当dCas9-VP64通过gRNA靶向到目标基因的启动子序列时募集调节目标基因启动子的转录因子实现转录激活。然而,dCas9-VP64仅仅低强度地激活靶基因表达。在这个基础之上,研究人员又尝试将其他不同的激活剂与dCas9串联在一起,于是产生了以下3个系统。
1.1 SunTag系统
在超新星标签(SUperNovaTag, SunTag) 系统中,dCas9与串联的重复多肽GCN4融合,并且每个重复多肽GCN4与带有转录调控因子的单链可变区片段抗体(single chain fragment variable, scFv) 结合实现转录调控。与最原始的dCas9-VP64相比,使用SunTag系统可以将多个转录调控因子如十一易位蛋白(ten-eleven translocation, TET) 或其他调控元件X募集到dCas9上,实现多效激活,如图 2所示。
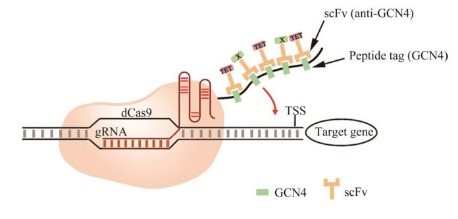
图 2 改良SunTag系统可同时招募TET和其他转录调控元件Fig. 2 Modified SunTag system for simultaneous recruitment of TET and another factor (factor X). |
图选项 |
1.2 dCas9-VPR系统
研究人员将一系列已知的具有转录作用的候选效应子融合到dCas9的C末端,在人类HEK 293T细胞中对报告基因进行荧光分析,评估它们的转录激活效率。在这些被测试的复合蛋白中,dCas9-VP64、dCas9-p65和dCas9-Rta的激活效果最佳。其中,VP64是单纯疱疹蛋白16的TAD四聚体,p65则是核因子κB (nuclear factor kappa-B, NF-κB) 蛋白质家族中的成员,通过和该家族中的p50结合形成蛋白质二聚体后执行转录激活的功能。转录激活蛋白(replication and transcription activator, Rta) 主要由Y疱疹病毒ORF50所编码,是Y疱疹病毒中具有序列保守性的一个蛋白分子。进一步以dCas9-VP64为起始支架在C端扩展融合上p65和Rta构成VP64-p65-Rta (VPR) 激活元件,如图 3所示。与最原始的dCas9-VP64激活元件相比,dCas9-VPR表现出更高的内源性靶标激活水平,从22倍提高到了320倍。
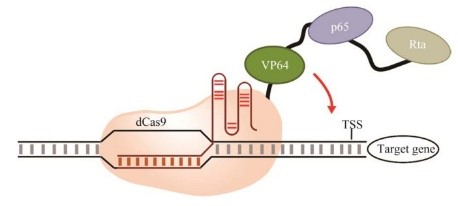 |
图 3 dCas9-VPR系统图示Fig. 3 The diagram of dCas9-VPR system. The dCas9 fused with VP64-p65-Rta to activate the target gene. |
图选项 |
1.3 dCas9-TV系统
Li等用VP16的八聚体VP128代替了VP64来修饰dCas9-VP64,观察到dCas9-VP128可以将LUC激活5倍以上,胜过了dCas9-VP64的2倍效果。然后引入了包括EDLL和ERF2m (modified ERF2) 以及来自黄单胞菌(Xanthamonas) TALE的TAD作为增强dCas9-VP128活性的第二步。结果显示,VP128与最多4个拷贝的串联ERF2m-EDLL基序的组合可以激活LUC表达,相对于基础水平,其激活效率高达12.6倍;将VP128与最多6个拷贝的TALE TAD (TAL) 结合,LUC表达的最大激活程度超过了55倍。因此他们得出结论,dCas9-6TAL-VP128是强转录激活因子,并命名为dCas9-TV,如图 4所示。Xiong等利用dCas9-TV同时将水稻中的OsGW7和OsER1上调高达3 738倍,活性至少可以持续到第4代。同时在拟南芥中实现AtFLS2的转录上调。
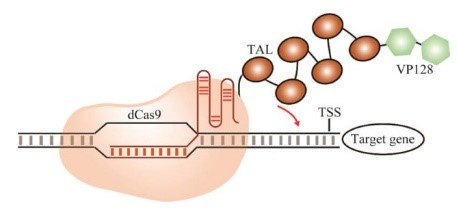 |
图 4 dCas9-TV系统图示Fig. 4 The diagram of dCas9-TV system. |
图选项 |
2 改造gRNA成为招募转录激活效应子的支架
研究RNA定位的常用方法是将MS2噬菌体外壳蛋白(ms2 phage coat protein, MCP) 与绿色荧光蛋白(green fluorescent protein, GFP) 融合结合RNA 3'UTR区域中的MS2发卡结构,用GFP分子标记RNA分子。RNA固有的模块化和可编程性,使其可以用于协调生物组装。首先,RNA可以通过碱基互补配对的原则识别DNA靶标;其次,RNA拥有RNA-蛋白质相互作用域,用来募集特定的蛋白质。在以往的研究中,RNA支架协调功能蛋白组装的能力已经得到了很好的证明。利用CRISPR/dCas9系统进行转录激活的第二种策略是将gRNA作为支架并招募转录激活效应子。
2.1 scRNA系统
Zalatan等使用能够募集RNA结合蛋白的RNA域去扩展CRISPR系统本身的gRNA序列,使其成为支架RNA (scaffold RNA, scRNA),实现了通过修饰gRNA募集转录激活因子,实现对特定基因进行转录激活的功能。
在这套系统中,研究人员首先将识别招募转录激活因子模块MS2、PP7和com的RNA发夹结构域引入gRNA的3'末端,再分别由MCP、PCP和Com RNA结合蛋白识别,随后再将转录激活因子VP64融合到相应的RNA结合蛋白上,如图 5所示。
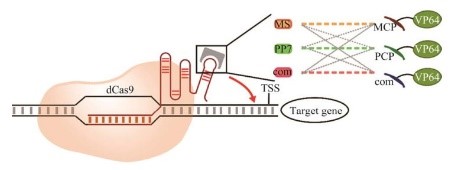 |
图 5 scRNA系统图示Fig. 5 The diagram of scRNA system. |
图选项 |
2.2 SAM系统
协同激活系统(synergistic activation mediator, SAM)的构建仍旧是通过改造gRNA茎环来实现的。Konermann等确定了dCas9的晶体结构,并观察到gRNA的茎环远端4 bp完全不与Cas9的氨基酸侧链相互作用,因此茎环4和茎环2可以添加与蛋白质相互作用的RNA域,以促进转录激活因子向dCas9复合物的募集。为了进一步提高dCas9介导的基因激活效率,研究人员通过MS2将带有VP64的dCas9融合蛋白和NF-κB反式激活亚基p65结合在一起,再引入人热休克因子1 (human heat shock transcription factor 1, HSF1) 的激活域作为第三激活域,如图 6所示。
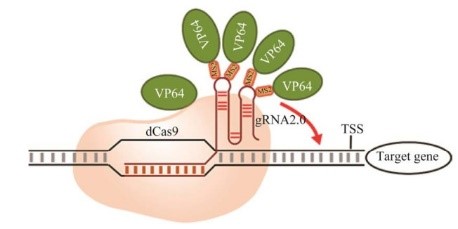 |
图 6 SAM系统图示Fig. 6 The diagram of SAM system. |
图选项 |
2.3 CRISPR-Act2.0系统
CRISPR-Act2.0系统是一种改进的多重转录激活系统。通过改变gRNA的结构,在gRNA的茎环上引入MS2,创造多个MS2茎环,再将MCP-VP64蛋白募集到结合位点上。这套系统可以将4个VP64蛋白招募到gRNA上,再加上dCas9-VP64复合物本身带有的一个VP64,这套系统总共可以将5个激活剂带到目标位置上,如图 7所示。CRISPR-Act2.0系统与之前的dCas9-VP64相比,将转录激活的效率提高了3–4倍。
 |
图 7 CRISPR-Act2.0系统图示Fig. 7 The diagram of CRISPR-Act2.0 system. |
图选项 |
2.4 CRISPR-Act3.0系统
Pan等结合了dCas9-VP64、gR2.0支架、10xGCN4 SunTag和新开发的2xTAD激活剂构成新的激活系统CRISPR-Act3.0,如图 8所示。该系统可实现多基因高效激活。为实现更多识别结合位点进一步将Cas9替换为CRISPR-Cas12b或SpCas9变体SpRY,扩展CRISPR激活的靶向范围。
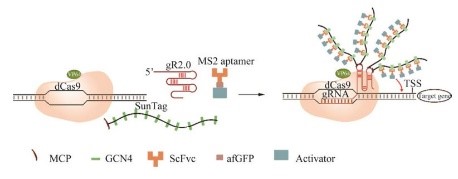 |
图 8 CRISPR-Act3.0系统图示Fig. 8 The diagram of CRISPR-Act3.0 system. |
图选项 |
在功能基因组学中,一个核心问题是定义基因表达与表型特征之间的因果关系。CRISPR激活体系提供了一种新的方法,通过靶向植物中的基因激活来简化和加速此类研究。为了提高CRISPR的激活效力,靶向灵活性和可扩展性,未来CRISPR激活系统依旧存在改进提升的空间。