023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


Tomás, H.A., Rodrigues, A.F., Carrondo, M.J.T. et al. LentiPro26: novel stable cell lines for constitutive lentiviral vector production. Sci Rep 8, 5271 (2018). https://doi.org/10.1038/s41598-018-23593-y
慢病毒载体是促进基因转移和稳定基因表达的良好工具。它们的潜力已经在基因疗法治疗各种疾病的临床试验中得到证明。对于大规模的LV生产,稳定的生产者系统是理想的,因为它允许可扩展的和成本有效的病毒生产,具有增加的可重复性和安全性。然而,稳定系统的开发具有挑战性且耗时,主要限制在于选择呈现高表达水平Gag-Pro-Pol多蛋白的细胞以及与一些病毒成分相关的细胞毒性。在此描述了使用突变的活性较低的病毒蛋白酶建立新的LV生产细胞系,以克服潜在的细胞毒性限制。双顺反子表达盒的稳定转染以及翻译机制的重新启动使得能够产生支持高滴度的LentiPro26包装群体。此外,通过跳过中间克隆筛选步骤并仅进行一次最终克隆筛选,有可能节省时间并在不到6个月的时间内产生组成型产生滴度超过106 tu . ml-1 . day-1的LentiPro26-A59细胞系。这项工作是朝着开发改良的LV生产细胞系前进了一步,旨在有效地提供临床扩展的基因治疗应用。
tisagenlecleucel的批准标志着LVs进入基因治疗领域的临床-市场过渡,预计需要大规模生产临床级LV制剂。传统上,LVs的生产依赖于用四种表达盒瞬时共转染HEK293T细胞:(I)编码病毒结构蛋白和酶的Gag-Pro-Pol;(ii) Rev,编码在病毒基因组核输出中起重要作用的Rev辅助蛋白;(iii)包膜,编码与靶细胞受体相互作用以介导病毒细胞进入的糖蛋白;和(iv)载体基因组,携带待包装到生产的病毒颗粒中的目的基因。瞬态低压生产易于在小规模下进行。然而,短暂的低压生产很难扩大规模。另外的缺点包括高质量可转染DNA和转染试剂的高成本、批与批之间的显著差异和短的生产周期10。在这种情况下,非常需要稳定的组成型生产高滴度LV的LV细胞系。然而,这种细胞系的产生具有挑战性且耗时,需要几个转导/转染和选择步骤,所有这些步骤都与克隆分离、扩增和筛选相结合,以找到最佳的LV生产克隆。此外,水泡性口炎病毒(VSV-G)包膜(假型LV最常用的包膜)的HIV-1蛋白酶和糖蛋白的细胞毒性阻碍了稳定LV生产细胞系的建立。
为了解决细胞毒性问题,已经开发了具有表达病毒成分的诱导系统的细胞系10。然而,当使用这些可诱导的细胞系时,LV的产生在诱导后仅维持很短的时间,并且可能需要额外的纯化步骤来去除诱导剂10。迄今为止,仅报道了三种组成型表达所有LV成分(Gag-Pro-Pol、REV、包膜和载体基因组)的细胞系。在所有情况下,选择具有稳定和高表达Gag-Pro-Pol的克隆似乎是主要的挑战,难以仅通过传统的质粒细胞转染来开发稳定的高滴度LV生产细胞系。为了克服表达限制,开发了几种策略,使用病毒载体将LV组分引入细胞基因组,促进它们的高表达,并促进产生高LV滴度的克隆的建立。STAR衍生细胞系11是第一个建立的LV生产细胞系。在其发展过程中,γ-RVs被用于将gag-pro-pol密码子优化的和rev表达盒整合到HEK293T细胞的基因组中。剩余的LV成分通过质粒细胞转染导入。STAR的建立证明了有可能开发出组成型支持高LV生产力的细胞系。然而,STAR细胞系开发中使用的γ-RVs的长末端重复序列(LTRs)和包装序列(ψ)存在于LV生产细胞的基因组中,这可能会促进具有复制能力的慢病毒(RCL)的产生,从而引起安全性问题12。几年后,使用重组杂交杆状-AAV载体成功地将gag-pro-pol和rev基因整合到细胞基因组中,避免了γ-RVs13的使用,开发了RD2-MolPack-Chim3 LV生产细胞系。使用SIN-LVs引入Tat和包膜基因,以最小化可能的安全性问题14,15。后期特异性分析证明了RD2-MolPack-Chim3细胞系的安全性13。最近,在WinPac衍生的细胞系开发中,一种不同的方法使用γ-RVs将报道基因表达盒整合到细胞基因组中,以鉴定支持高报道基因表达水平的克隆16。随后,通过Cre重组酶介导的盒交换(RMCE ),用含有密码子优化的LV gag-pro-pol序列的新盒替换该报道基因表达盒。通过传统的质粒细胞转染引入剩余的LV组分。在盒子交换过程中去除大部分γ-RV序列降低了RCL形成的风险。然而,RMCE的使用需要额外的克隆分离和筛选步骤,使得细胞系的发展更加漫长和费力。
提到的所有三种LV生产细胞系反映了对改进的稳定LV生产系统的积极需求。本文描述了加速建立呈现高滴度的LV生产细胞系的替代方法,在整个细胞系发育过程中,仅通过使用化学转染和抗生素选择步骤。
结果
使用T26S突变或野生型病毒蛋白酶的瞬时LV生产
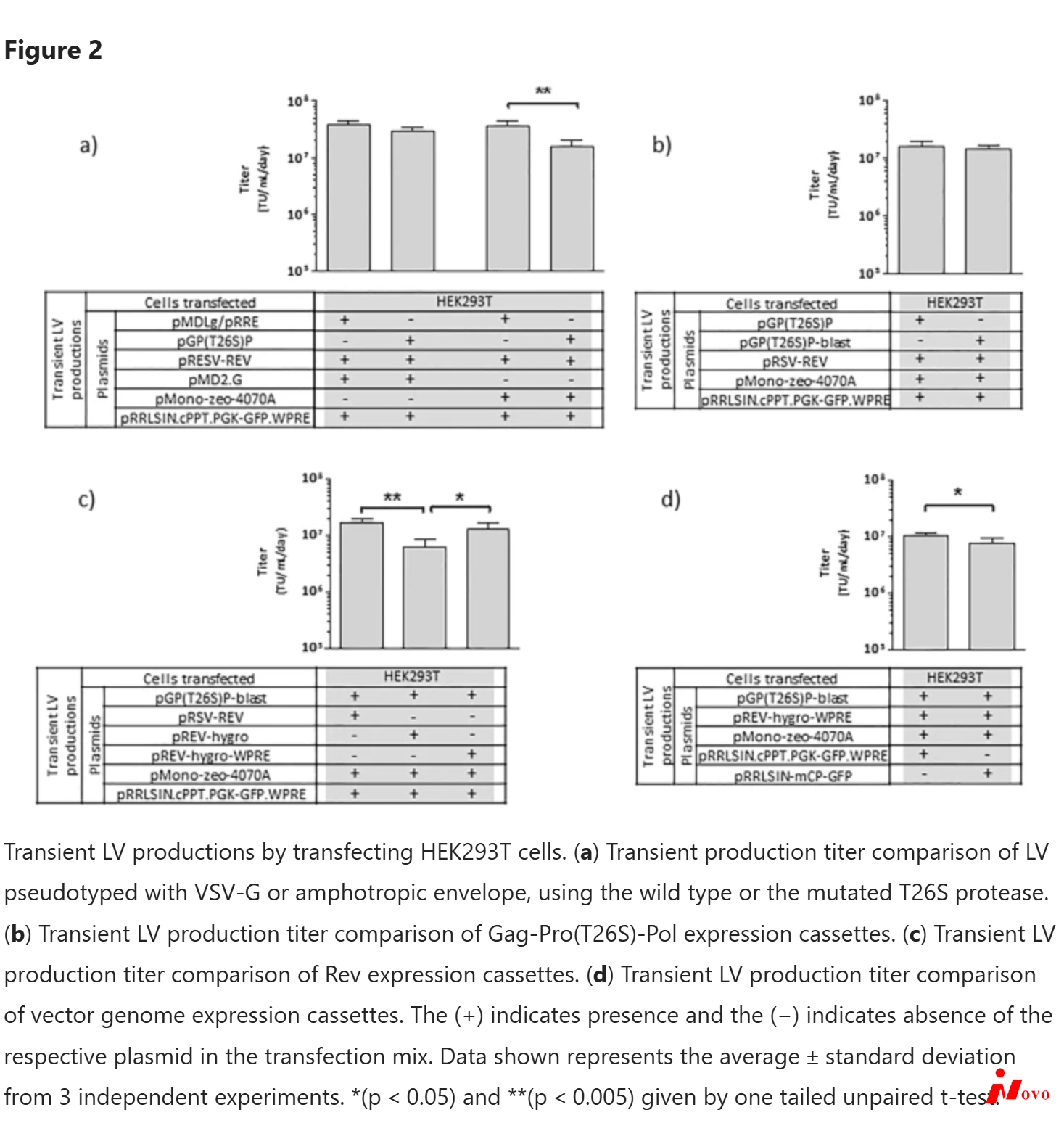
在pMDLg/pRRE质粒2的病毒蛋白酶中进行T26S点突变,产生pGP(T26S)P(图1a)。据报道,这种突变降低了蛋白酶活性,而不影响病毒的成熟和感染性17,当稳定表达时,可能导致细胞毒性降低。最终,这可能支持Gag-Pro(T26S)-Pol的更高表达水平。T26S蛋白酶的功能性通过用VSV-G或双嗜性包膜假型化的LVs的瞬时产生来评估(图2a)。作为对照,还评估了野生型蛋白酶。使用VSV-G包膜的LV生产没有观察到感染性病毒滴度的差异,而使用具有双嗜性包膜的T26S突变蛋白酶的病毒生产检测到感染性LV滴度降低2倍。所有LV产品的滴度都达到了107 tu . ml-1 . day-1以上,双嗜性包膜用于建立稳定的细胞系。
构建慢病毒元件稳定表达框
为了能够选择具有第三代LV包装功能(Gag-Pro-Pol和Rev)的高和稳定表达的群体,将选择性标记的表达与每种病毒成分的表达相联系。在pGP(T26S)P质粒的情况下,引入杀稻瘟菌素抗性基因(bsr)并通过81 bp间隔区与gag-pro(T26S)-pol基因的表达偶联,驱动翻译机制的重新启动18,19。该机制支持高表达细胞的选择,并已成功用于建立稳定和高滴度的γ-逆转录病毒载体生产细胞系20,21,22。这种新的pGP(T26S)-blast质粒(图1a)用于瞬时LV生产,当与使用pGP(T26S)P的LV生产相比时,滴度没有差异(图2b)。
为了稳定的rev表达,将潮霉素B抗生素抗性基因(hph)插入pRSV-REV质粒2的Rev编码序列之后,产生前潮霉素(图1b);rev和hph基因的表达也通过翻译机制的重新启动而紧密相连。当在瞬时LV生产中使用pREV-hygro时,观察到LV滴度降低(图2c)。注意到在Rev表达盒中加入hph基因导致Rev mRNA转录物长度增加3倍,这可能降低mRNA的稳定性,从而降低慢病毒的产量。因此,一个土拨鼠肝炎转录后调控元件(WPRE)被插入hph基因的下游,据报道,它能增加mRNA的稳定性并帮助病毒mRNA核输出23,24。用这种新质粒,pREV-hygro-WPRE(图1b),获得了与pRSV-REV相似的病毒滴度(图2c)。
自我灭活(SIN)慢病毒载体基因组安全性的提高正在成为临床级LV生产的标准要求25,26,27。为此,SIN载体基因组质粒pRRLSIN.cPPT.PGK-GFP。WPRE(图1d)被用作载体骨架。在合理使用其它LV组分后,将抗生素抗性标记引入该载体基因组表达盒,以促进选择表达高水平SIN-LV基因组的细胞。在这种情况下,嘌呤霉素抗生素抗性基因(pac)被克隆到PGK启动子的上游,以区分LTR-RSV驱动的mRNA和内部PGK启动子驱动的转录物。此外,嘌呤霉素抗性基因的表达通过翻译机制的重新启动与mCherry报告基因的表达偶联,旨在促进具有高载体基因组表达的克隆的分离。这种新的pRRLSIN-mCP-GFP质粒的功能性通过瞬时LV生产进行评估,其滴度接近于用pRRLSIN.cPPT.PGK-GFP.WPRE获得的滴度。(图2d)。
构建LentiPro26包装细胞
LV生产细胞系的发育是通过用pGP(T26S)P-blast稳定转染HEK293T细胞来启动的。转染后,施加抗生素选择压力(图3a ),选择杀稻瘟菌素抗性群体,命名为293T-GP(T26S)P。该群体应由具有不同Gag-Pro(T26S)-Pol表达水平(低/中/高)的细胞库组成。为了证实Gag-Pro(T26S)-Pol稳定表达,用剩余的LV组分(Rev、VSV-G包膜和SIN载体基因组)瞬时转染该群体,递送9×105 tu . ml-1 . day-1的平均滴度(图3b)。作为转染对照,该群体也用所有LV组分瞬时转染(图3b)。在后一种情况下,大多数细胞应含有pGP(T26S)P-bl质粒的几个游离拷贝,从而增加产生的病毒载体滴度,1×107 tu . ml-1 . day-1。
随着细胞系的发展,LentiPro26群体被编码MLV两性包膜的质粒pMONO-zeo-4070A稳定转染(图1c)。在该质粒中,zeocin抗生素抗性基因(Sh ble)的表达通过口蹄疫病毒28的内部核糖体进入位点(IRES)与包膜表达偶联。按照上面使用的选择方法,转染的细胞用zeocin培养三周。然后将所得的LentiPro26-4070A群体进行额外的三重选择步骤(杀稻瘟菌素、潮霉素和zeocin)一周(图3a),随后通过半稳定的LV生产评估病毒组分的稳定表达(图3b)。LentiPro26-4070A半稳定LV生产产生的效价为7×105 tu . ml-1 . day-1。
稳定的LV生产细胞系的建立
为了最终建立组成型生产LVs的细胞群体,用pRRLSIN-mCP-GFP质粒转染LentiPro26-4070A群体,并进行三周的嘌呤霉素选择,然后用所有抗生素进行一周的选择(图3a)。新的抗性细胞群体呈现了宽范围的报道蛋白强度水平,99% GFP阳性,94% mCherry阳性(图3c)。该群体被称为LentiPro26-4070A-mCPGFP,表现出1.5×105 tu . ml-1 . day-1的稳定左心室产量(图3d)。为了找到最佳的LV生产细胞克隆,通过荧光激活细胞分选分离出110个具有高mCherry强度荧光的克隆,并进行小规模(2 cm2)稳定的LV生产(图4a)。在所有抗生素存在的情况下,扩增并培养前10个LV生产克隆。在25 cm2组织培养瓶中进行第二次稳定的LV生产,以评估病毒生产率。克隆59,从现在起命名为LentiPro26-A59,表现出最高的LV产量(图4b,c),1.6×106 tu . ml-1 . day-1,比亲本LentiPro26-4070A-mCPGFP群体高10倍。选择该克隆用于进一步表征和工艺优化。
“培养基/生长面积”比值对稳定LV生产的影响
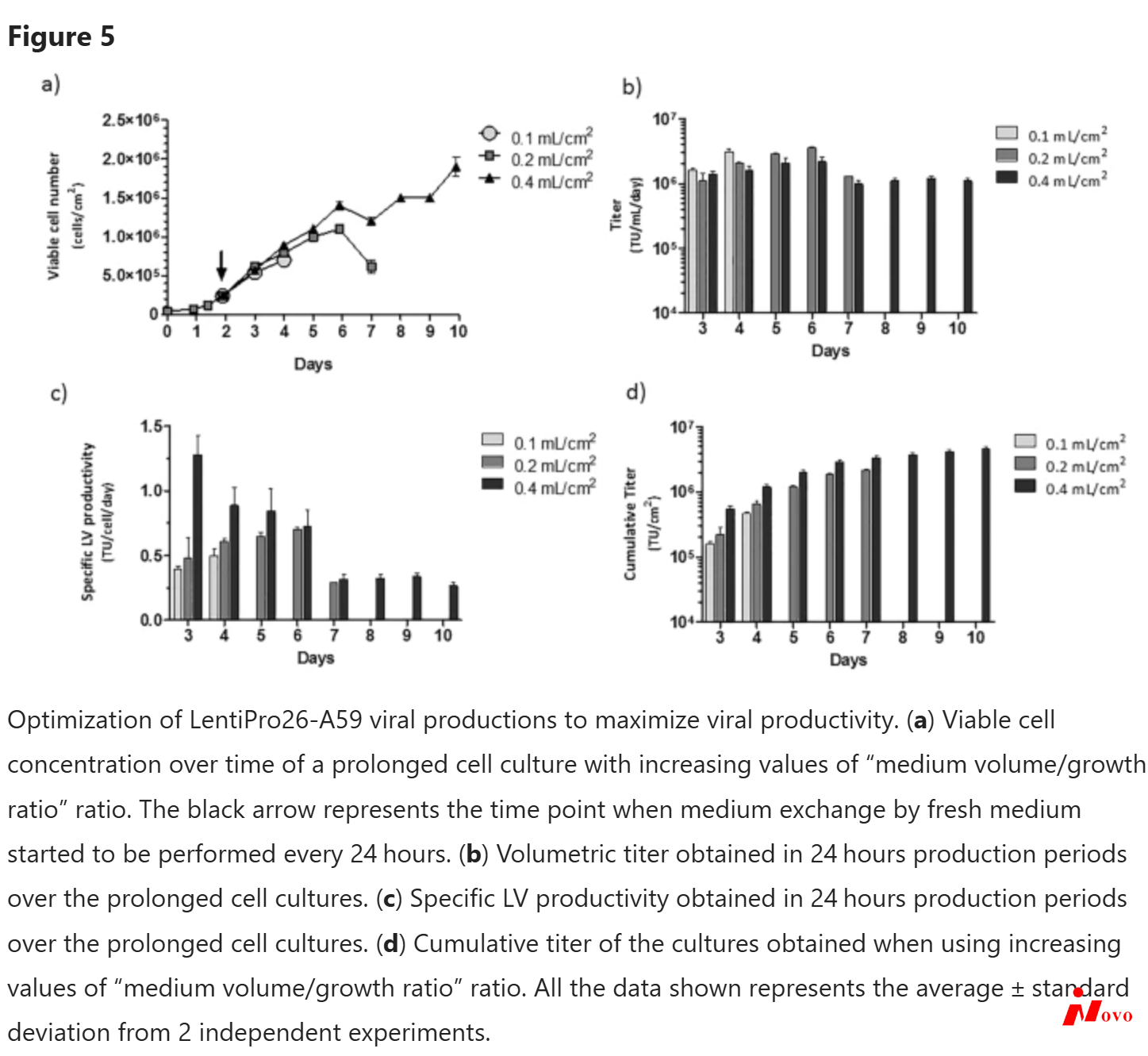
减少慢病毒生产中的培养基工作体积是增加上清液病毒浓度的常用策略。因此,在稳定的LentiPro26-A59病毒生产中,使用0.1、0.2和0.4 mL/cm2的比值来评估每生长面积的培养基体积比率对细胞生长和病毒生产率的影响。从0.1到0.2 mL/cm2的比率复制允许三次额外的收获,滴度超过1×106 tu . mL 1 . day 1。当体积/面积比从0.1增加到0.4 mL/cm2时,细胞培养进一步延长,允许六次额外收获,再次呈现1×106 tu . mL-1 . day-1的平均滴度(图5a,b)。值得注意的是,在生产的前3天检测到比病毒生产率的增加(图5c ),并且在培养结束时,使用0.4 mL/cm2的比率获得了4.7 × 106 TU/cm2的累积滴度(图5d)。
丁酸钠对lent pro 26-A59稳定病毒生产的影响
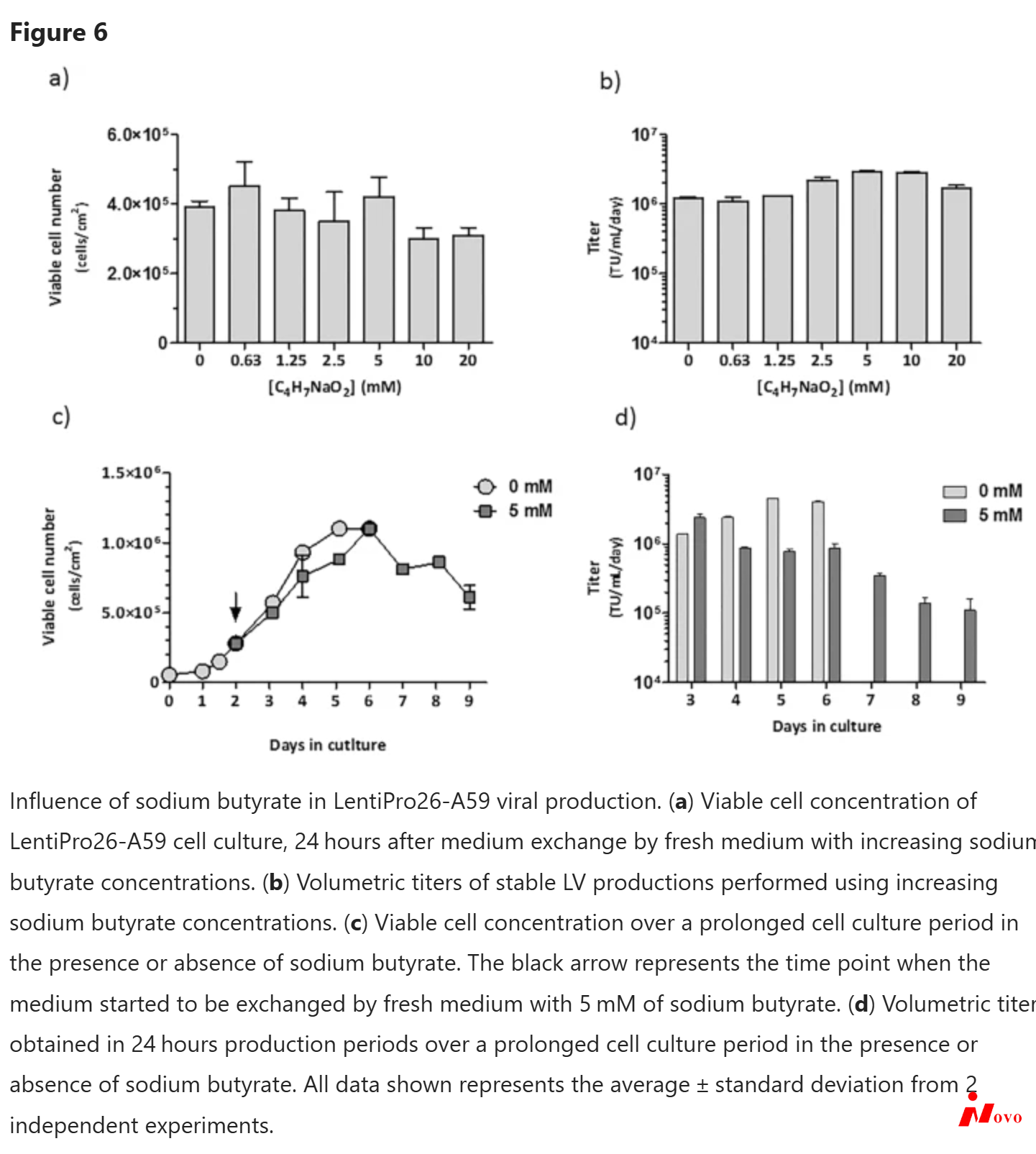
据报道,向培养基中添加丁酸钠可增加贴壁和悬浮瞬产生的慢病毒滴度29,30。然而,没有关于稳定LV生产的数据。在本文中,我们使用0.2 mL/cm2的体积/面积比评估了几种丁酸钠浓度对24小时LentiPro26-A59稳定LV生产的影响(图6a,b)。对于具有5 mM和10 mM浓度的丁酸钠的LV产品,获得了3倍的体积滴度增加;然而,对于10 mM和20 mM浓度,观察到较低的细胞生长。因此,选择5 mM浓度来评价丁酸钠在延长的细胞培养期内对细胞生长和病毒生产率的影响,每24小时更换一次培养基。在没有丁酸钠的情况下,细胞在第5天达到最大浓度,仅存活到第6天。在丁酸钠存在下,细胞达到与没有丁酸钠时相同的最大浓度,但是一天后,存活至第9天(图6c)。这种延长的存活可能与丁酸钠存在下培养基的较低酸化有关(在培养期间通过酚红pH指示剂检测)。相反,在没有丁酸钠的情况下,观察到pH降低。关于病毒生产率,在与丁酸钠接触的第一个24小时中检测到LV滴度增加2倍(图6d),与先前的结果一致(图6b)。然而,在接下来的几天中,滴度下降到低于1×106 tu . ml-1 . day-1的值。
讨论
这项工作描述了HIV-1衍生的LV生产细胞系的发展过程,该细胞系仅基于病毒构建体的化学转染,表现出超过106 tu . ml-1 . day-1的稳定病毒生产力。此处使用的质粒来自于Dull等,2中描述的第三代系统,保持gag-pro-pol/rev裂解盒方法并保持载体基因组的自失活设计。此外,除了载体基因组表达盒,没有进一步的逆转录病毒LTRs或ψ序列用于提高安全性标准。
为了最小化与病毒蛋白酶活性相关的潜在细胞毒性问题,使用了含有活性较低的T26S突变蛋白酶17的Gag-Pro-Pol构建体。该策略可支持建立更健壮的细胞系,可能允许更高水平的gag-pro-pol表达,这已被报道为开发高效价LV生产细胞系的主要限制之一。
关于包膜糖蛋白,尽管VSV-G假型LVs的滴度较高(图2a),但其细胞毒性不允许其组成型表达10。无毒的MLV两性信封被用作概念证明。其它无毒包膜糖蛋白可以组成型表达为假型LV,例如来自长臂猿白血病病毒(GaLV)31或来自猫内源性逆转录病毒(RD114)的修饰糖蛋白
为了指导表达高水平LV成分的细胞的选择,使用翻译机制或IRES的重新启动将不同选择性标记的表达与LV成分的表达紧密偶联(图1)。在Gag-Pro-Pol表达盒的特定情况下,Gag-Pro-Pol相对于Gag多蛋白32,33的较低核糖体翻译速率,与间隔区18,19(选择性标记)后的基因翻译效率降低相关,驱动高严格选择过程,并因此促进选择间隔区上游基因(病毒成分)具有高表达水平的细胞。
HEK293T细胞的顺序PEI转染和抗生素选择,首先用Gag-Pro(T26)-Pol,其次用Rev表达盒,允许建立LentiPro26包装群体。通过用SIN载体基因组和VSV-G或双嗜性包膜表达盒转染LentiPro26细胞(图3b),半稳定LV产物产生的滴度类似于或甚至高于通过其它报道的包装细胞系PK-7(4×106 tu . ml-1 . day-1)13和win pack-57r 10(3×105 tu . ml-1 . day-1)16的半稳定转染获得的滴度,这证明了质粒转染后对组成型Gag-Pro(T26S)进行抗生素选择过程的潜力具有双嗜性包膜的LentiPro26群体的稳定转染允许选择包装群体LentiPro26-4070A,当用SIN载体基因组质粒瞬时转染时,其能够产生7×105 tu . ml-1 . day-1(图3b)。使用其亲代群体LentiPro26在以前的半稳定LV生产中获得了相同的滴度,表明在LentiPro26-4070A群体中双嗜性包膜的稳定表达不限制病毒生产。
除了Gag-Pro-Pol,载体基因组的更高表达水平可能对维持高滴度也很重要。这是稳定的γ-RV生产细胞系22,34的情况。为了改进对具有载体基因组高表达水平的细胞的选择,在嵌合LTR-RSV启动子的控制下,将选择性标记基因(嘌呤霉素)的表达与报道基因(mCherry)的表达相结合(图1d);翻译机制的重新启动也被用于确保表达高mCherry水平的细胞的严格选择。使用这种新的载体基因组设计,mCherry表达与载体基因组转录物的表达直接相关,该转录物将被包裹在产生的新LVs中。基于mCherry强度,通过荧光激活细胞分选分离载体基因组高表达水平的克隆。该策略被证明是成功的,因为分离的10个顶级克隆中的9个递送的体积滴度在跨实验比较时似乎优于亲代群体(图3d和4b)。表现出较高LV生产力的克隆,命名为LentiPro26-A59,支持接近2×106 tu . ml-1 . day-1的滴度,当跨实验比较时,产生比亲代群体多约10倍的LV(图3d和4b)。这些LV包装群体和LV生产细胞系是概念证明,本研究中开发的策略可用于在更短时间内产生LV生产细胞系。此外,证明了仅通过传统的转染和随后的抗生素选择过程就可能产生相对高滴度的LV生产细胞。Gag-Pro-Pol、Rev和包膜表达盒中缺乏逆转录病毒LTRs和ψ序列也可能有助于更安全的细胞系分布。其它方法如RMCE35,36,37,密码子优化11,16,串联阵列25或其它方法可用于建立新的改良的和更安全的高滴度LV生产细胞系。此外,对LV组分表达水平、LV制剂质量、LV自体转移的可能性的全面表征,以及对RCL形成和LV基因动员的仔细分析,对于进一步表征新的LentiPro26衍生的细胞系是重要的。
从单个培养物或甚至连续生产中进行多次上清液收获的可能性是稳定的LV生产者系统的主要优点,由于其短的半衰期而减少了LV衰变38,39,因此,使其成为产生更高感染性的更具成本效益的生产过程。通过将LentiPro26-A59稳定生产的“体积/生长面积”比值从0.1操纵至0.4 mL/cm2,我们能够增加细胞生产率并延长培养时间,导致累积滴度增加超过10倍(图5d)。我们通过在培养基中加入丁酸钠进一步提高了体积滴度。丁酸钠是哺乳动物细胞中众所周知的组蛋白脱乙酰酶抑制剂;通过阻止DNA压缩,它改善了mRNA转录,同时也改善了蛋白质生产40。尽管在短期生产期间LV产量有少量增加,丁酸钠的存在削弱了长期培养中的病毒产量(图6d)。Sakoda及其同事也报道了类似的观察结果,41其中丁酸钠延长细胞处理降低了左心室生成。对病毒生产能力具有更直接作用的其它补充剂或代谢工程方法也可用于进一步增加LV生产。
LV生产随时间的稳定性和大规模病毒生产的可再现性是稳定LV生产细胞系的商业和临床成功实施的决定性因素。LentiPro26-A59细胞系在不存在抗生素的情况下显示出持续近一个月的LV产生,在存在抗生素的情况下显示出持续至少两个月的LV产生。此外,通过接种单个HYPERFlask,收获了总共3.4 L平均滴度为1 × 106 TU/mL的上清液。这些结果验证了LentiPro26-A59细胞系的可重复性和可扩展性,证明了其适应连续大规模生产系统的潜力。
已知哺乳动物细胞中异源基因的几种沉默机制损害蛋白质生产45,46。LentiPro26-A59病毒生产力随时间下降的一个可能解释是Gag-Pro(T26S)-Pol表达盒中CMV启动子47的表观遗传沉默。随着时间的推移,进一步分析每种LV组分的表达水平和细胞基因组中各自的拷贝数,可能有助于理解和找到避免病毒生产力随时间损失的解决方案。
本研究中使用的理性策略大大降低了复杂性,并加速了持续生产LVs的潜在更安全细胞系的产生过程,使其类似于γ-RV生产细胞系建立过程48。密码子使用、病毒包膜糖蛋白和培养条件的进一步优化甚至可能增加LV的生产率和安全性,从而产生有竞争力的LV生产细胞系以满足基因治疗临床应用的需求。